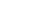GPCR受体技术的挑战与突破
G蛋白偶联受体(GPCRs)是细胞膜上的重要信号受体,参与了细胞感知外部信号并调控内部反应的过程。尽管GPCR在生理过程中扮演着重要角色,但它们并不是“模块化”的结构。这意味着,改变其配体特异性通常需要依赖繁琐的结构诱变和定向进化,不仅耗时长,且操作复杂。为了克服这一局限,Alice Ting教授团队利用纳米抗体设计了一种条件性自抑制结构域,通过简化GPCR的调控机制,提供了更为灵活和模块化的解决方案。
一、创新设计:条件性自抑制结构域与纳米抗体结合
这一研究的核心创新在于结合了纳米抗体和条件性自抑制结构域,使得GPCR能够根据外部信号精准激活,而无需经过传统的复杂修改。条件性自抑制结构域:研究者为GPCR设计了一个条件性自抑制结构域,位于受体的细胞外N末端,这个结构域能够使GPCR在没有外部激活的情况下保持抑制状态,从而避免受体信号的非特异性激活。
纳米抗体的引入:纳米抗体是源自骆驼科动物的小型抗体片段,具有高亲和力和小尺寸的优势。在此研究中,纳米抗体被设计并融合到GPCR的细胞外部分。这种纳米抗体与GPCR上的自抑制结构域形成了互斥关系——当特定抗原结合到纳米抗体时,抑制结构域的作用会被解除,GPCR因此被激活。
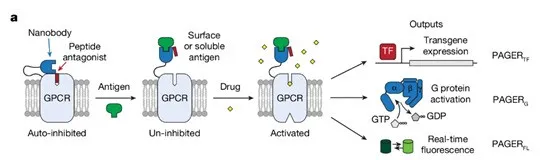
图1. PAGER的基本设计
二、多重输出:精准调控细胞行为
一旦这一合成GPCR系统(PAGER)被激活,它可以驱动多种细胞行为输出,包括:转基因表达(PAGERTF)、内源性G蛋白通路激活(PAGERG)、实时荧光监测(PAGERFL)
转基因表达系统(PAGERTF)
PAGERTF系统的目标是通过PAGER的激活驱动特定基因的表达。此系统能够在细胞中精确调控基因的开关,适用于基因功能研究和基因治疗等应用。
图2. PAGERTF系统:PAGER驱动转基因表达
当纳米抗体与特定抗原结合后,PAGER系统被激活,从而触发与转基因表达相关的调控机制。研究人员设计了与PAGER系统相连的转基因表达模块,可以在PAGER被激活时启动目标基因的表达。并且为了验证PAGER的模块化应用,研究团队将抗原结合的纳米抗体替换为针对不同抗原的纳米抗体,从而生成能够感知和响应新抗原的功能性受体。他们使用了10种GFP纳米抗体和6种mCherry纳米抗体,替换了PAGERTF中的GFP纳米抗体。结果表明,最优的抗GFP PAGERTF(包含LaG2纳米抗体)能够检测到低至1.5nM的FP,与已报道的LaG217(16–19nM)的解离常数(KD)相符;而最优的抗mCherry PAGERTF(含LaM8纳米抗体)则能检测到100nM的mCherry。这两种PAGER对其他荧光蛋白没有反应,证明了其高度的特异性。
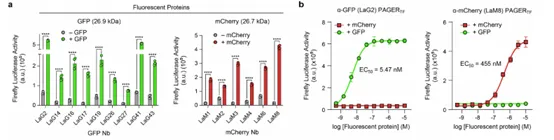
图3. 在PAGERTF中测试多种GFP和mCherry纳米体
实时荧光系统(PAGERFL)
PAGERFL系统的目标是实现通过纳米抗体响应特定抗原时,快速并实时地监测细胞的状态变化。当纳米抗体与抗原结合时,PAGER系统被激活,并通过荧光标记物提供实时的细胞反应反馈。
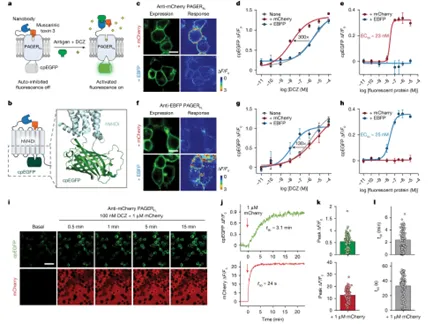
图4.PAGERFL用于实时荧光检测细胞外抗原
内源性G蛋白激活系统
PAGERG系统的目的是通过激活内源性的G蛋白信号通路来调控细胞的生理过程,如增殖、分化、迁移等。通过纳米抗体结合抗原,PAGER系统被激活,从而触发G蛋白信号通路的启动。为拓展应用,研究团队探索了将抗原识别转化为内源性G蛋白通路的激活,进而调控细胞行为。通过优化,构建了PAGERGq、PAGERGs、PAGERGi和PAGERG12系统。
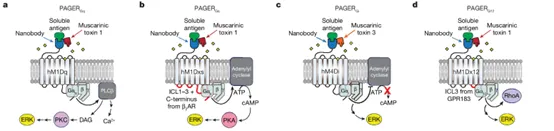
图5. PAGERGq、PAGERGs、PAGERGi和PAGERG12的设计和激活
研究团队对四个PAGERG系统进行了多层次的WB、BRET等实验,验证了PAGERG通过抗原识别激活内源性G蛋白通路。此外,利用AF2预测了PAGERGq的结构,揭示了肌肉毒素(MT1)自抑制作用,以及纳米抗体(蓝色)结合抗原(绿色)后解除自抑制的效果。
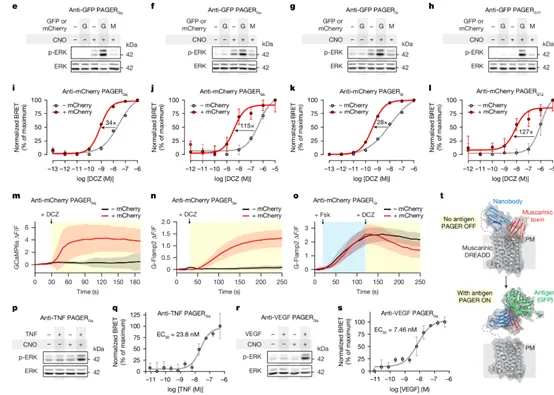
图6. 验证PAGERG偶联抗原识别到内源性G蛋白信号的激活
作者进一步展示了PAGERG在复杂场景下的应用:PAGERG能够调控急性脑切片和原代T细胞的多种细胞行为。综合数据表明,PAGERG可响应可溶性或细胞附着抗原,实现对神经元活性、T细胞迁移等复杂细胞行为的重编程,展现出巨大的应用潜力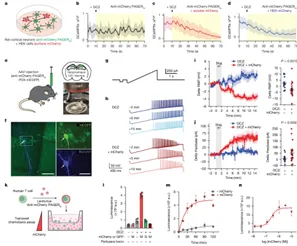
图7. PAGERG在急性脑片和原代T细胞中控制多种细胞行为