GPCR的信号转导
通过GPCR激活的信号通路取决于GPCR本身的一级序列和三级结构,但最终由特定配体稳定的特定构象以及参与的信号转导分子决定。目前,GPCR被认为主要使用两种类型的信号转导分子:G蛋白和β-arrestins [1]。因为β-arrestin仅对磷酸化形式的GPCR具有高亲和力,所以大多数信号转导最终由G蛋白激活介导。同时,由于GPCR与其他信号转导分子有相互作用的可能性,因此也存在非G 蛋白介导的信号转导形式发生。
处于活性状态的GPCR受体蛋白遇到G蛋白,则可能结合并激活G蛋白。 一些证据表明GPCR和G蛋白实际上是预先偶联的 [2]。例如,G蛋白与GPCR受体蛋白的结合会影响受体对配体的亲和力。
进一步的信号转导取决于G蛋白的类型。例如,腺苷酸环化酶可受G蛋白(Gs)调节。 腺苷酸环化酶在与活化的Gαs亚基结合时,其活性被激活。当G蛋白返回到GDP结合状态时,腺苷酸环化酶的激活被终止。腺苷酸环化酶(其中 9 种为膜蛋白形式,1种为可溶蛋白形式)也可以通过其他方式被激活或抑制,例如Ca2+与钙调蛋白结合[3]。
G蛋白介导的信号转导
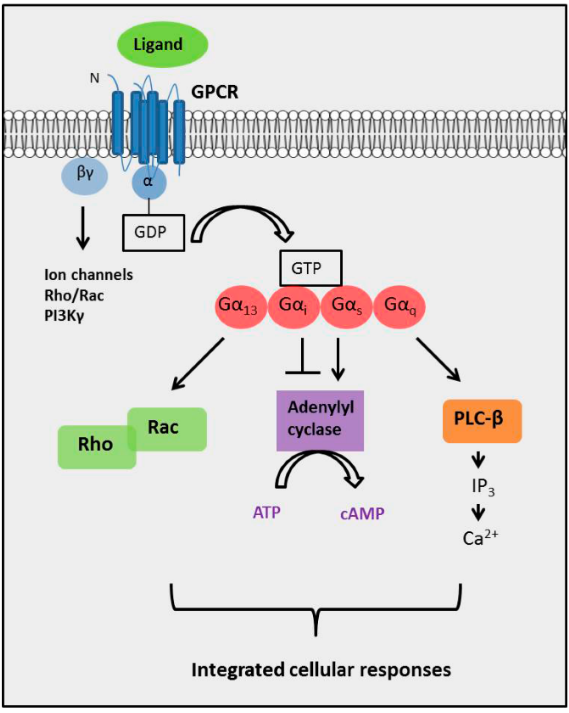
G蛋白介导的信号通路[4]
目前已知三种主要的G蛋白介导的信号通路,由四类G 蛋白(Gαs、Gαi/o、Gαq/11 和 Gα12/13)介导。每一类G 蛋白都由多种蛋白质组成,每种蛋白质都是多个基因或剪接变异的产物,这些变异可能使它们在信号特性方面存在不同程度的差异,但总的来说,它们大致可以归为以上四类。 由于各种Gβγ 组合的信号转导特性彼此之间似乎没有根本差异,因此这些类别是根据其 α 亚基的亚型定义的 [5]。
虽然大多数 GPCR 能够激活不止一种Gα亚型,但它们也表现出对某一种亚型的偏好。 当激活的亚型取决于与 GPCR 结合的配体时,这种行为称为功能选择性,也称为激动剂定向传导(agonist-directed trafficking)或构象特异性激活(conformation-specific agonism)。 然而,由于激动剂可能能够稳定GPCR中GEF结构域的多个构象,一种激动剂也可能激活G 蛋白。 当受体偏好的 Gα亚型浓度较低时,则可能会激活另一种。 此外,反馈途径可能导致受体修饰(例如磷酸化),从而改变G蛋白偏好。 尽管存在这些细微差别,GPCR的首选偶联伙伴通常是以在大多数生理或实验条件下最明显被内源配体激活的 G 蛋白来定义的 [6]。
Gα信号通路
1. 细胞质 cAMP的水平可能决定各种离子通道的活性以及 ser/thr 特异性蛋白激酶 A (PKA) 家族的成员。 因此,cAMP 被认为是第二信使,而 PKA 是次级效应器。Gαs 和 Gαi/o 途径的效应物都是生成cAMP的腺苷酸环化酶(adenylate cyclase, AC)。 虽然哺乳动物中有 10 种不同的 AC 基因,每一种在组织分布或功能上都有细微差别,但它们都直接受到Gαs蛋白的刺激,催化细胞质中三磷酸腺苷 (ATP) 向cAMP的转化。相反,与Gαi/o中的Gα亚基结合会抑制AC产生cAMP。 因此,与Gαs偶联的GPCR和与 Gαi/o偶联的GPCR的作用相抵消[7]。
cAMP信号通路包含5类主要成员:刺激性激素受体(Rs)或抑制性激素受体(Ri); 刺激性 G 蛋白 (Gs) 或抑制性G 蛋白 (Gi); 腺苷酸环化酶(AC); 蛋白激酶 A (PKA); 和cAMP磷酸二酯酶。刺激性激素受体(Rs)是一种能与刺激性信号分子结合的受体,与刺激性G 蛋白相偶联,其α亚基激活后可刺激酶的活性或其他细胞内代谢。而抑制性激素受体(Ri)是一种能与抑制性信号分子结合的受体,抑制性G 蛋白与其结合后, α 亚基被激活并抑制酶的活性或其他细胞内代谢[8]。
腺苷酸环化酶是一种12次跨膜糖蛋白,可在 Mg2+或 Mn2+的帮助下催化ATP转化为 cAMP, 产生的cAMP 是细胞代谢的第二信使,是蛋白激酶A的变构激活剂。蛋白激酶A是细胞代谢中重要的酶,它能够通过将代谢途径中特定的酶磷酸化来调节细胞代谢。它还可以调节特定的基因表达、细胞分泌和膜通透性。该酶包含两个催化亚基和两个调节亚基。 当没有 cAMP时,复合体不活跃。 当cAMP与调节亚基结合时,其构象发生改变,导致调节亚基解离,从而激活蛋白激酶A并产生进一步的生物学效应。这些信号可以被 cAMP磷酸二酯酶终止。cAMP 磷酸二酯酶是一种将 cAMP 降解为 5'-AMP 并使蛋白激酶 A 失活的酶。
2. Gαq/11通路的效应物是磷脂酶C-β(PLCβ),它催化磷脂酰肌醇4,5-二磷酸(PIP2)裂解成第二信使肌醇(1,4,5)三磷酸(IP3) 和甘油二酯 (DAG)。 IP3 作用于内质网 (ER) 膜中的IP3受体,引起Ca2+从ER释放,而DAG沿质膜扩散,激活位于膜上的蛋白激酶C(PKC)。 由于许多 PKC 亚型也被细胞内Ca2+水平的升高激活,因此这两种途径也可以相互汇聚,通过相同的次级效应器传递信号。细胞内升高的Ca2+也会结合并激活钙调蛋白,后者又会产生GTP 酶 Rho。 一旦与 GTP 结合,Rho 就可以继续激活负责细胞骨架调节的各种蛋白质,例如 Rho 激酶 (ROCK)。 大多数与 Gα12/13 偶联的 GPCR 也与其他亚型的G蛋白偶联,通常是 Gαq/11 [9]。
Gβγ 信号传导
Gβγ介导的信号转导也很重要,特别是对于与Gαi/o偶联的GPCR。Gβγ 的主要效应物是各种离子通道,例如G蛋白调节的内向整流K+通道 (GIRK)、P/Q和N型电压门控 Ca2+ 通道, AC和 PLC的一些亚型,以及一些磷酸肌醇 3 激酶 (PI3K) [10]。
非G蛋白介导的信号通路
尽管传统上认为GPCR与G蛋白只能一起发挥功能,但 GPCR 实际上可能不通过 G 蛋白的机制传递信号,并且G 蛋白也可能独立于 GPCR 发挥作用。 GPCR 可以通过许多其他蛋白实现信号传递,例如 β-arrestins、GRKs 和 Srcs。 此类信号传递已被证明具有生理相关性。例如,趋化因子受体 CXCR3 介导的 β-arrestin 信号对于活化 T 细胞的有效趋化作用是必需的。 [11] 此外,参与 GPCR 亚细胞定位的其他支架蛋白(例如,含有 PDZ 结构域的蛋白)也可以参与信号转导。 大多数情况下,其效应物是 MAPK 家族的成员。
参考文献
1. Lohse MJ, Benovic JL, Codina J, Caron MG, Lefkowitz RJ (June 1990). "beta-Arrestin: a protein that regulates beta-adrenergic receptor function". Science. 248 (4962): 1547–50.
2. Qin K, Dong C, Wu G, Lambert NA (August 2011). "Inactive-state preassembly of G(q)-coupled receptors and G(q) heterotrimers". Nature Chemical Biology. 7 (10): 740–7
3. Sanchez-Collado J, et al. Rev Physiol Biochem Pharmacol. 2021. PMID: 33398503 Review.
4. Lynch JR, et al. Int J Mol Sci. 2016. PMID: 27187360 Free PMC article. Review.
5. Viktoriya Syrovatkina, Kamela O. Alegre, Raja Dey, Xin-Yun Huang, Regulation, Signaling and Physiological Functions of G-proteins, J Mol Biol. 2016 Sep 25; 428(19): 3850–3868.
6. Asuka Inoue, et al. Illuminating G-Protein-Coupling Selectivity of GPCRs, Cell. 2019 Jun 13;177(7):1933-1947.
7. Manuela Zaccolo, Anna Zerio, Miguel J. Lobo, Subcellular Organization of the cAMP Signaling Pathway, Pharmacol Rev. 2021 Jan; 73(1): 278–309.
8. Kuo Yan et al., The cyclic AMP signaling pathway: Exploring targets for successful drug discovery, Mol Med Rep. 2016 May; 13(5): 3715–3723.
9. Dinesh Kankanamge, Sithurandi Ubeysinghe, Mithila Tennakoon, Priyanka Devi Pantula, Kishalay Mitra, Lopamudra Giri, Ajith Karunarathne, Dissociation of the G protein βγ from the Gq–PLCβ complex partially attenuates PIP2 hydrolysis, J Biol Chem. 2021 Jan-Jun; 296: 100702.
10. Mari Kiyono, Takaya Satoh, and Yoshito Kaziro, G protein βγ subunit-dependent Rac-guanine nucleotide exchange activity of Ras-GRF1/CDC25Mm, Proc Natl Acad Sci USA. 1999 Apr 27; 96(9): 4826–4831.
11. Smith JS, Nicholson LT, Suwanpradid J, Glenn RA, Knape NM, Alagesan P, et al. (November 2018). "Biased agonists of the chemokine receptor CXCR3 differentially control chemotaxis and inflammation". Science Signaling. 11 (555): eaaq1075.