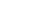热门抗体靶点梳理(2/2)
接上期,纳米抗体因其低免疫原性,高特异性,高稳定性等特性被应用于多种恶行疾病的治疗与诊断中,本期小编将继续介绍抗体药物的部分热门靶点。
表一、本期介绍的热门靶点的基本信息
| 靶点名称 | Uniport编号 | 分子量(kDa) | 长度(a.a.) | 亚细胞定位 |
| CTLA-4 | P16410 | 24.66 | 223 | l类单次跨膜蛋白 |
| BCMA | Q02223 | 20.17 | 184 | III类单次跨膜蛋白 |
| VEGF | P15692 | 27.04 | 232 | 分泌蛋白 |
| TNFa | P01375 | 25.64 | 233 | ll类单次跨膜蛋白 |
CTLA-4
CTLA-4(cytotoxic T lymphocyte antigen 4)基因最早由法国科学家于1987年发现1,随后,其功能被陆续揭晓(图1)。CTLA-4是免疫球蛋白超家族成员,是一种检查点分子,主要在免疫细胞(如T细胞)与抗原呈递细胞之间进行信号转导和免疫调节。CTLA-4与CD28可与相同的配体结合(CD80和CD86),但功能相反,CTLA-4是一种关键的抑制性受体,尤其在免疫反应的启动阶段起着重要作用。在静息的T细胞中,CTLA-4位于细胞内,当T细胞通过CD28刺激被活化后,CTLA-4会转运至T细胞表面。CTLA-4与CD28竞争结合并阻断T细胞激活,从而抑制T细胞的活化过程2。通过这一作用,CTLA-4可以抑制免疫系统攻击人体自身组织,避免自身免疫病的发生,同时也有可能阻止T细胞对肿瘤细胞的攻击。因此,针对CTLA-4的药物已被广泛应用于肿瘤治疗领域。
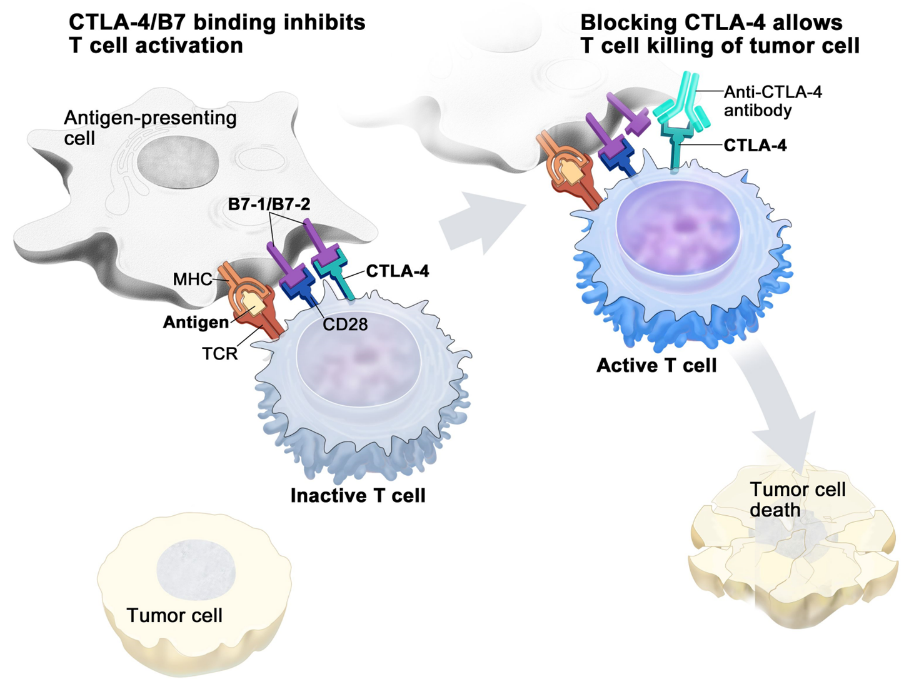
图1. CTLA-4的作用机制
(https://www.cancer.gov/publications/dictionaries/cancer-terms/def/ctla-4)
CTLA-4单抗(Ipilimumab,施贵宝公司,2011年于美国获批用于晚期黑色素瘤的治疗)是早期开发的免疫检查点抑制剂,先于PD-1单抗出现,但因其毒性较高,疗效有限,被PD-1单抗超越,不再被推荐作为晚期黑色素瘤的一线治疗单药。另一款CTLA-4单抗类药物Tremelimumab的临床研究进展较为曲折,2015年被FDA批准为治疗恶性间皮瘤(malignant mesothelioma,MM)的孤儿药,2017年、2019年及2020年用于治疗非小细胞肺癌(NSCLC)或膀胱癌的三期临床实验均宣告失败,2020年2月又由FDA授予治疗肝细胞癌(HepatocellularcarcinomaHCC)的孤儿药资格。Tremelimumab为hIgG2亚型,无ADCC效应,单药疗效较差。
为解决CTLA-4单抗药物面临的困境,双特异性抗体及纳米抗体成为了破局者,如靶向PD-1/CTLA-4的四价抗体Cadonilimab,靶向PD-L1/CTLA-4的KN046,以及阿斯利康的靶向PD-1/CTLA-4的双特异性抗体MEDI5752都具有较强的抗肿瘤活性。此外,和铂医药开发的纳米抗体药物HBM4003,经过改造,可显著增强ADCC并增加Treg细胞耗竭。
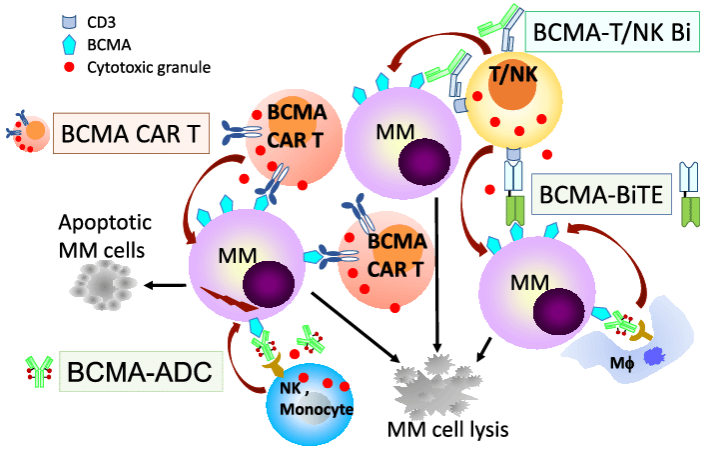
图2. 靶向BCMA的免疫疗法的作用机制3
BCMA(B cell maturation antigen)是肿瘤坏死因子(TNF)受体家族的成员,是表达于较成熟B细胞和浆细胞上的跨膜蛋白。BCMA主要通过介导B细胞到浆细胞分化过程中的信号转导途径,参与了免疫系统的调节和炎症反应等生理过程。
在肿瘤学领域,BCMA也已经成为多发性骨髓瘤(multiplemyeloma,MM)的治疗靶点之一。目前,针对BCMA的单抗药物、生物特异性药物和CAR-T细胞等治疗手段已被广泛探讨(图2)3。其中,BCMA单克隆抗体药物依赖于抗原特异性,可以通过识别BCMA,直接作用于多发性骨髓瘤(MM)细胞表面,促进巨噬细胞介导的抗肿瘤活性;而CAR-T细胞具有特异性杀伤CD19-以及CD38+恶性浆细胞的能力,这使得针对BCMA的CAR-T细胞治疗可能对MM等一些难以治愈的癌症产生显著的治疗效果。2022年传奇生物研发的靶向BCMA首款纳米抗体CAR-T细胞获得FDA批准上市,成为中国首个进入美国市场的细胞产品。
VEGF (vascular endothelial growth factor)是一种血管内皮细胞生长因子,它在许多肿瘤中都有过表达的情况。VEGF可以促进新生血管的形成,并为肿瘤提供养分和氧气,从而促进肿瘤的生长和转移(图3)。因此,VEGF成为了一种重要的靶点。
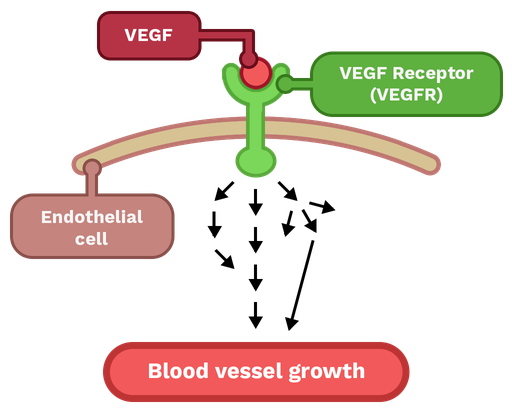
图3. VEGF与其受体结合后可促进血管的生成 (https://theory.labster.com/vegf/)
目前已经开发出多种针对VEGF的抗体药物,包括:
贝伐珠单抗(bevacizumab):2004年获得美国FDA批准上市,目前已批准用于治疗多种癌症,包括晚期结直肠癌、肺癌、乳腺癌、肾癌、恶性胶质瘤等。在中国,该药于2010年获得上市批准,用于治疗转移性结直肠癌,并于2015年获得批准作为一线治疗用于晚期、转移性或复发性非鳞非小细胞肺癌;
阿柏西普(aflibercept)是由再生元公司研发的一种结合VEGF的Fc融合蛋白。它于2011年获得美国FDA批准上市。目前,阿柏西普在欧美被批准用于治疗四种疾病,分别是湿性老年性黄斑变性(AMD)、视网膜中央静脉阻塞继发黄斑水肿(CRVO-ME)、糖尿病性黄斑水肿(DME)和近视脉络膜新生血管(mCNV)引起的视觉障碍。在中国,阿柏西普于2018年2月13日获得国家药品监督管理总局批准,用于治疗糖尿病性黄斑水肿(DME);
康柏西普(Conbercept)是由成都康弘生物科技有限公司研发的新一代抗VEGF融合蛋白,也是中国首个获得世界卫生组织国际通用名的具有全自主知识产权的生物类新药。康柏西普于2013年获得上市批准,最初适应证为老年性黄斑变性(AMD)。在2017年,它获得了新的适应证——病理性近视(PM)继发的脉络膜新生血管(pmCNV)引起的视力下降。RVO-ME、DME等新的适应证已于2020年12月进入临床三期实验。这些药物可以通过不同的机制来抑制VEGF的活性,从而阻止肿瘤血管的形成并达到治疗疾病的效果。
TNFα
肿瘤坏死因子(Tumor Necrosis Factor,简称TNF)是一类细胞因子,主要由巨噬细胞产生。它具有多种生物学功能,包括调节免疫细胞的活化、增殖和分化,促进炎症反应,以及诱导细胞凋亡(图4)4。TNF-α(肿瘤坏死因子-α)是TNF家族中最常见且功能最为重要的成员。
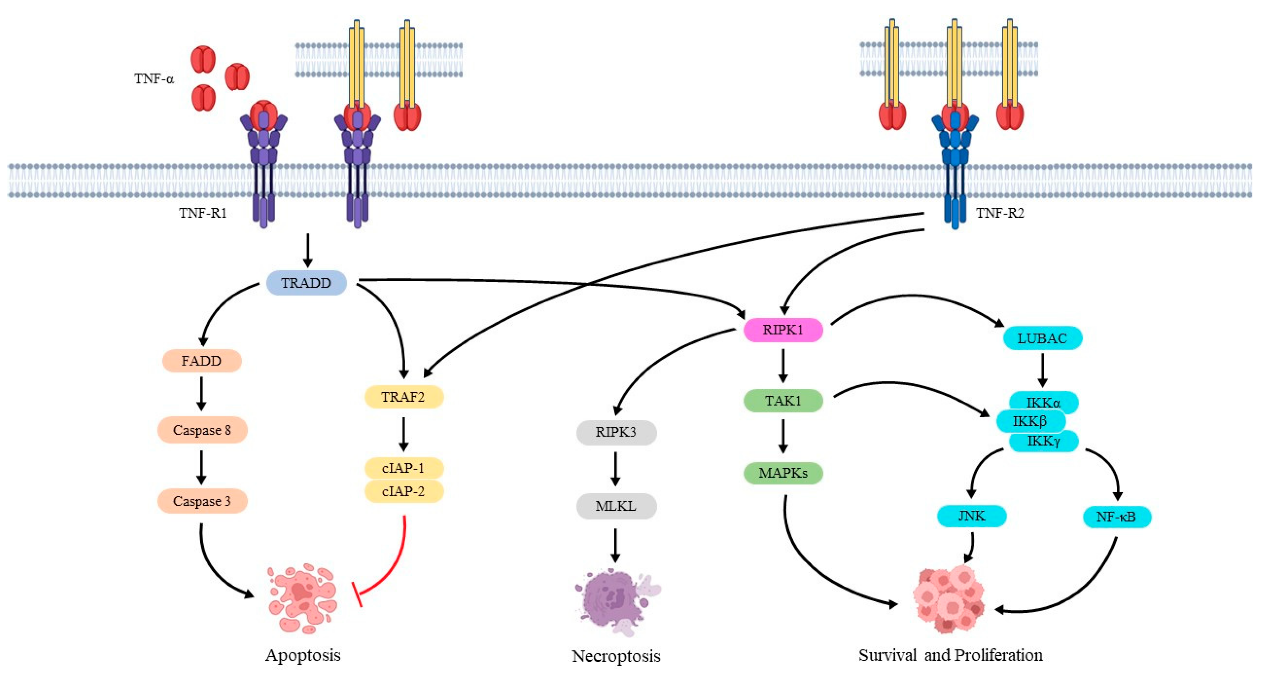
图4.TNF-α的信号通路4
由于TNF-α在许多炎性和自身免疫性疾病中发挥关键作用,因此抑制TNF-α的生物活性可以作为治疗这类疾病的有效策略。抗TNF-α药物主要是指针对TNF-α的单克隆抗体或可溶性受体蛋白,可以通过干扰TNF-α与其受体结合来抑制其生物活性。目前已有多种抗TNF-α药物被用于临床治疗:
英夫利西(Infliximab):是一种鼠-人嵌合型单克隆抗体,主要用于治疗类风湿关节炎、强直性脊柱炎、克罗恩病(Crohn’s disease, CD)和溃疡性结肠炎等炎症性疾病。
阿达木单抗(Adalimumab):是一种全人源化单克隆抗体,适用于多种自身免疫性疾病,如类风湿关节炎、强直性脊柱炎、银屑病关节炎、克罗恩病和溃疡性结肠炎等。
戈利木单抗(Golimumab):是一种全人源化单克隆抗体,可用于治疗类风湿关节炎、强直性脊柱炎、银屑病关节炎和溃疡性结肠炎等疾病。
奥索拉珠单抗(Ozoralizumab,又称为ATN-103)是一款针对肿瘤坏死因子-α(TNF-α)的骨架优化型全人源化纳米抗体药物。它通过特异性地结合和中和TNF-α,从而抑制其生物活性,达到治疗炎症相关疾病的目的。奥索拉珠单抗的主要研发初衷是改善现有抗TNF-α药物的安全性和耐受性。由于其独特的“三聚体”结构,奥索拉珠单抗具有较低的分子量和更高的选择性,能够在关节腔内积累并保持长时间的生物活性。这使得奥索拉珠单抗相较于传统抗TNF-α药物,在维持疗效的同时可能降低感染和其他系统性副作用的风险。目前,奥索拉珠单抗主要在自身免疫性疾病领域的治疗中得到研究,如类风湿性关节炎、强直性脊柱炎等。临床试验表明,奥索拉珠单抗在治疗类风湿性关节炎等疾病方面表现出良好的安全性和耐受性。
V565是一种口服TNFα纳米抗体药物,目前已经完成临床二期实验。TNFα的抗体对治疗克罗恩病非常有效,但主要用药方式为静脉注射或皮下注射,V565创新的采用了口服的给药方式。V565的二期临床实验评估了口服V565对活动性CD患者的疗效,疗程为6周。研究纳入了125例回肠或结肠疾病患者,随机分配其中2/3接受口服V565治疗,1/3接受安慰剂治疗,随访时间为28天。主要评估指标为临床响应,定义第42天时CDAI-70(克罗恩病活动指数)减少,并且炎症标志物减少。研究结果显示,两组患者的临床缓解率没有明显差异(V565组为35.4%,安慰剂组为37.2%),但治疗组的内镜改善率较高(V565组为56.3%,安慰剂组为30.0%)。两组间严重不良事件的发生率相似。
Brunet, J.-F. et al. A new member of the immunoglobulin superfamily—CTLA-4. Nature 328, 267-270 (1987). 2Van Coillie, S., Wiernicki, B. & Xu, J. Molecular and cellular functions of CTLA-4. Regulation of Cancer Immune Checkpoints: Molecular and Cellular Mechanisms and Therapy, 7-32 (2020).
Cho, S.-F., Anderson, K. C. & Tai, Y.-T. Targeting B cell maturation antigen (BCMA) in multiple myeloma: potential uses of BCMA-based immunotherapy. Frontiers in immunology 9, 1821 (2018).
Leone, G. M., Mangano, K., Petralia, M. C., Nicoletti, F. & Fagone, P. Past, Present and (Foreseeable) Future of Biological Anti-TNF Alpha Therapy. Journal of Clinical Medicine 12, 1630 (2023).