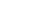纳米抗体的光影之旅 ——纳米抗体在医学成像中的应用
前言
疾病早期诊断及治疗评估依赖于医学成像。磁共振成像(MRI)和计算机断层扫描(CT)难以提供细胞或分子水平的信息。而肿瘤的异质性及组织活检的侵入性,限制了组织活检在分子水平成像中的应用。免疫成像技术很好的填补了这一空白。基于纳米抗体的免疫成像示踪剂具有靶向肿瘤组织的强特异性、较快的摄取速度及较高的肿瘤/本底比值。免疫成像有助于分析每个患者的独特分子模式,是精准医学的关键组成部分,对病人的分期、分型及提供个性化的治疗方法有重要作用1。本期内容将为大家介绍纳米抗体在医学成像中的优势及针对一些代表性靶点开发的纳米抗体探针的临床研究(图一)。
图一、纳米抗体应用于人类PET成像示意图
纳米抗体在医学成像中的优势
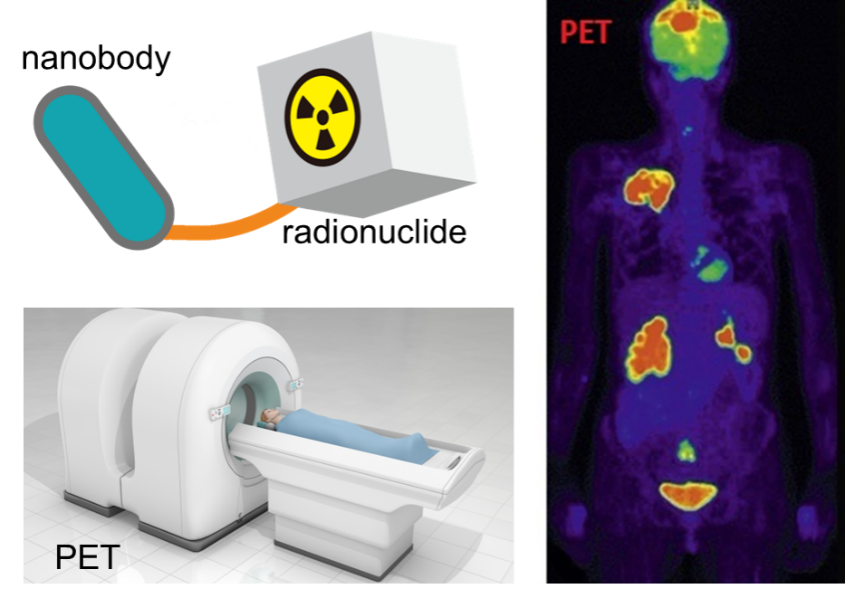
重链抗体(heavy chain antibodies, HCAbs)天然存在于骆驼科动物和护士鲨等软骨鱼中,其可变区(VHH)即为纳米抗体。VHHs是自然界中最小的抗原结合单位, 可通过免疫库、天然库或合成库获得,分子量约为12-15 kDa,直径< 4 nm,是传统抗体大小的十分之一,同时保持了很强的抗原识别能力。VHHs独特的理化性质使其在免疫成像领域脱颖而出,其优势主要有(图二):(1) VHHs和人3型VH序列高度相似,不易在人体中引起抗药反应,免疫原性低;(2) VHHs分子量小,有较深的组织穿透能力,血液清除率高;(3) 半衰期短,可实现较高的肿瘤/本底比值,注射1h后即可获得高对比度影像,常用18F、68Ga和99mTc等标记;(4) VHHs的互补位呈凸形结构,CDR3环较长,可结合传统抗体难以结合的抗原表位;(5) VHHs具有高热稳定性,能够抵抗较恶劣的环境;(6)易于修饰改造; (7)可用微生物发酵生产,产量高,批间差小。
图二、纳米抗体应用于免疫成像领域的优势
纳米抗体在肿瘤成像中的应用举例
1. 肿瘤标志物HER2成像
根据癌细胞表明不同蛋白的表达情况,乳腺癌可分为四类:雌激素阳性、黄体酮阳性、人表皮生长因子受体2(HER2)阳性和三阴性。HER2阳性乳腺癌占乳腺癌总发病率的20%~30%,HER2的表达水平可以反映此类乳腺癌的发展及治疗情况。但在疾病发展及治疗的过程中,HER2的表达水平处于不断变化中,故想要追踪HER2的表达水平需要不断进行活检。然而,乳腺癌具有高度异质性,活检结果无法全面反映原发灶与转移灶的HER2表达情况,且组织活检可能增加乳腺癌的远处转移概率。因此,HER2的无创检测至关重要2。
基于纳米抗体的分子成像手段作为后起之秀对HER2阳性乳腺癌的成像具有无创、特异性高、组织渗透性好、肿瘤/背景比高、能有效避免假阳性及假阴性结果等优点,能够实现对HER2阳性乳腺癌的精准分期及肿瘤异质性评价2。
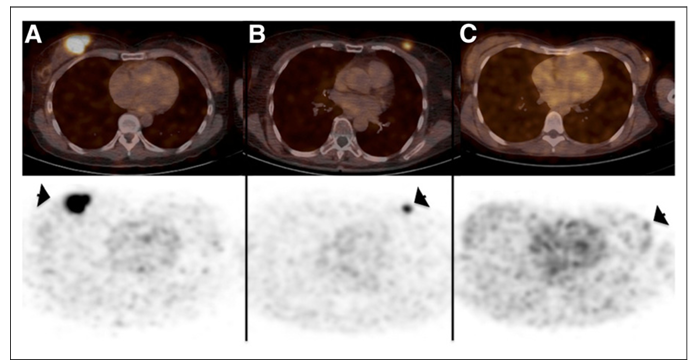
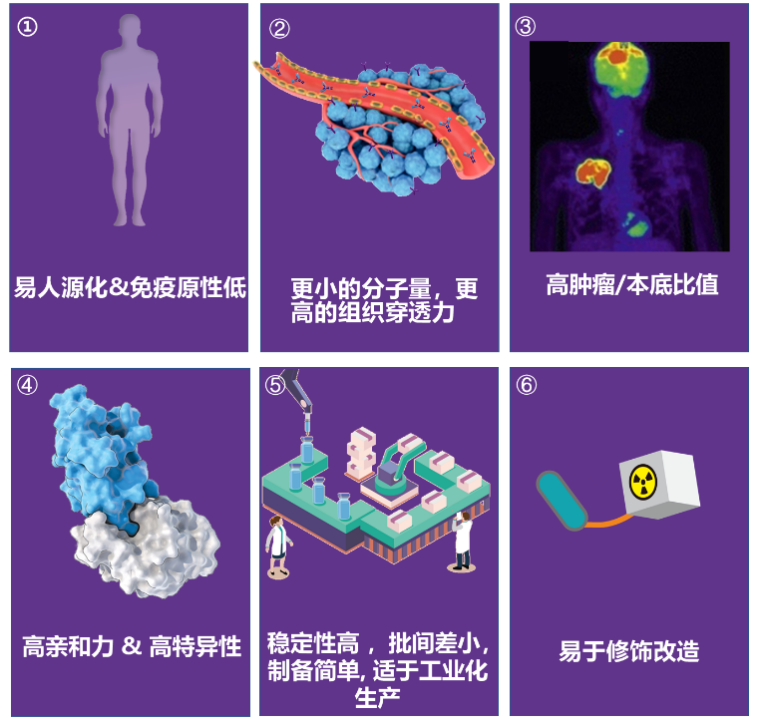
图三、PET/CT 图像(上图)和 PET 图像(下图)显示原发性乳腺癌病灶(箭头)中68-GaNOTA-Anti-HER2 VHH1的摄取。(A) 14号患者的示踪剂摄取最高(SUV 平均值,11.8)。(B) 15号患者显示中度示踪剂摄取,仍具有很高的肿瘤-背景比(SUV 平均值,4.9)。(C)6号患者成像结果显示没有摄取(SUV 平均值,0.9),CT图像的肿瘤区域用箭头指示。
HER2 纳米抗体示踪剂68-GaNOTA-Anti-HER2 VHH1在I期临床试验中取得了令人鼓舞的结果,68-GaNOTA-Anti-HER2 VHH1在肿瘤中的积累水平明显超过了背景值,且在HER2 阳性转移灶中有高积累。因此,该示踪剂顺利进入了II 期临床研究,目的是评价乳腺癌患者脑转移瘤对该示踪剂的摄取情况 (图三)(NCT03331601)3。基于68-GaNOTA-Anti-HER2 VHH1的优良性能,Precirix公司进而开发了[131I]-SGMIB Anti-HER2 VHH1示踪剂,现正在进行临床I 期试验,旨在评价该示踪剂的安全性、耐受性及有效剂量(NCT02683083)4。此外,另一款纳米抗体成像剂99mTc-NM-02正在进行I期临床研究 (NCT04040686)5,10位乳腺癌患者注射 3-12 MBq/kg 99mTc-NM-02, 无不良反应报道,且99mTc-NM-02的摄取与HER-2的表达呈正相关。近期,北京大学临床肿瘤学院研发的99mTc-MIRC208也正在临床实验中,共有200位受试者,旨在研究纳米抗体示踪剂99mTc-MIRC208对HER2阳性患者成像的可行性及特异性(NCT04591652)。
1. 免疫检查点PD-1/PD-L1成像
程序性死亡配体 1(PD-L1,基因名称:CD274)是一种细胞表面蛋白,通常在正常组织中表达,以平衡和下调细胞毒性 T 淋巴细胞 (CTLs) 的免疫反应。 这个过程是由 PD-L1 和程序性细胞死亡蛋白 1 (PD-1) 之间的相互作用介导的,PD-1 是一种在 CTL 表面发现的免疫调节蛋白,当与 PD-L1 结合时,CTL的细胞毒性会被抑制。 免疫检查点阻断疗法可触发 T 细胞(重新)激活,从而杀死癌细胞6。
PD-L1 在癌细胞上的表达已被证明与治疗结果相关,通过抑制 PD-1/PD-L1,许多癌症的预后得到了前所未有的改善。但PD-1/PD-L1抑制剂仅对 20-40% 的患者有效,主要因为PD-L1 的表达通常是异质性的,即使在同一肿瘤内也是如此,因此,对PD-L1的表达情况进行成像有重大价值7。
目前,成功用于临床及临床前研究的靶向PD-1/PD-L1纳米抗体探针已有超过7种,如 99mTc-MY15238,64Cu–DOTA–HAC 9,68Ga-NOTA-Nb10910,68Ga-NOTA-(hPD-L1)11,64Cu-NOTA-Nb612,89Zr-Df-KN035 13,99mTc-NM-0114等 。
68Ga-NOTA-(hPD-L1)的开发者在研究中探讨了VHH的互补决定区(CDR)内含有赖氨酸残基时,将纳米抗体与非特异性螯合剂反应后,纳米抗体分子影像剂的性能是否会受影响。研究者分别用VHH与NOTA螯合剂在其赖氨酸残基上随机偶联,或使用Sortase A进行定点偶联。分别注射入老鼠体内后约90分钟后成像的结果显示,随机结合的VHH的特异性肿瘤摄取量为1.77±0.29%IA/g,位点特异性结合的VHH的特异性肿瘤摄取量为1.89±0.40%IA/g。两种螯合物的显著稳定性表明,随机赖氨酸螯合可能是一种有吸引力的策略,更有利于放射性标记的纳米抗体的临床转化。
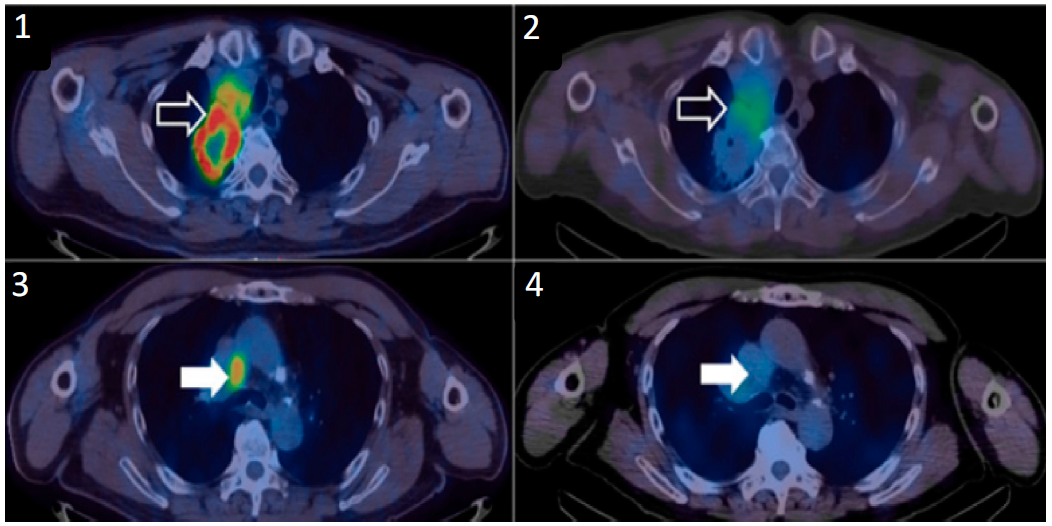
图四、99mTc-NM-01在(NSCLC)患者中的成像数据。患者的右上肺叶肿瘤显示了高[18F]FDG摄取(1);以及高99mTc-NM-01摄取(2);纵隔淋巴结显示了高[18F]FDG摄取(3);以及低99mTc-NM-01摄取(4);表明 PD-L1 在同一患者的原发肿瘤部位和远处疾病部位之间存在异质性表达6。
99mTc-NM-01此前已在中国完成了早期一期临床试验(NCT02978196)(图四),评估了99mTc标记的抗PD-L1纳米抗体在非小细胞肺癌(NSCLC)中的安全性、剂量学和成像效果,与金标准——组织活检相比,99mTc-NM-01成像结果具有良好的一致性,有可靠且非侵入性评估 PD-L1 表达的潜力。目前,该影像剂正在英国进行新一轮的临床试验(NCT04992715和NCT04436406),旨在评估99mTc-NM-01的诊断性能。
另一项临床试验(NCT03638804)目前正在使用89Zr–Fc融合纳米体(Enafolimab)来分析携带PD-L1阳性肿瘤的人类受试者的靶向摄取和生物分布。这种监测是通过PET成像进行的,同时也在评估这种Fc融合纳米体的安全性和必要的剂量测定等因素。
小结
本文阐明了纳米抗体为何被认为是肿瘤分子成像中的“灵丹妙药”,回顾了部分靶点如HER2,PD-L1的纳米抗体影像剂的最新进展。 随着当前诊断和治疗一体化的趋势,纳米抗体在这个新时代扮演着有利角色:在肿瘤诊断中,在定制和开始治疗方案之前的评估和预测中,在治疗过程中的动态监测中,在检测肿瘤复发的可能生态位中都有重要应用前景。纳米抗体也可能用于监测各种其他疾病,如淀粉样变性、病毒感染等,远超本文中提到的。 除了传统的 PET/CT 或 SPECT 成像外,纳米抗体的应用还可以进一步扩展到超分辨率成像,以研究蛋白质的结构、功能和蛋白质-蛋白质相互作用15。 总之,纳米抗体是一种多功能工具包,可以在临床应用和基础科学中发挥核心作用。
1 Vaneycken, I. et al. Immuno-imaging using nanobodies. Current Opinion in Biotechnology 22, 877-881 (2011).
2 Xavier, C. et al. 18F-nanobody for PET imaging of HER2 overexpressing tumors. Nuclear medicine and biology 43, 247-252 (2016).
3 Keyaerts, M. et al. Phase I study of 68Ga-HER2-nanobody for PET/CT assessment of HER2 expression in breast carcinoma. Journal of Nuclear Medicine 57, 27-33 (2016).
4 Ge, S. et al. radionuclide molecular imaging targeting HER2 in breast cancer with a focus on molecular probes into clinical trials and small peptides. Molecules 26, 6482 (2021).
5 Altunay, B. et al. 99mTc‑labeled single-domain antibody for SPECT/CT assessment of HER2 expression in diverse cancer types. European Journal of Nuclear Medicine and Molecular Imaging 50, 1005-1013 (2023).
6 Berland, L. et al. Nanobodies for medical imaging: about ready for prime time? Biomolecules 11, 637 (2021).
7 Bao, G., Tang, M., Zhao, J. & Zhu, X. Nanobody: a promising toolkit for molecular imaging and disease therapy. EJNMMI research 11, 1-13 (2021).
8 Gao, H. et al. Nuclear imaging-guided PD-L1 blockade therapy increases effectiveness of cancer immunotherapy. Journal for ImmunoTherapy of Cancer 8, e001156, doi:10.1136/jitc-2020-001156 (2020).
9 Maute, R. L. et al. Engineering high-affinity PD-1 variants for optimized immunotherapy and immuno-PET imaging. Proceedings of the National Academy of Sciences 112, E6506-E6514, doi:doi:10.1073/pnas.1519623112 (2015).
10 Qin, S. et al. A preclinical study: correlation between PD-L1 PET imaging and the prediction of therapy efficacy of MC38 tumor with 68Ga-labeled PD-L1 targeted nanobody. Aging (Albany NY) 13, 13006 (2021).
11 Bridoux, J. et al. Anti-human PD-L1 nanobody for immuno-PET imaging: validation of a conjugation strategy for clinical translation. Biomolecules 10, 1388 (2020).
12 Jiang, J. et al. Evaluation of 64Cu radiolabeled anti-hPD-L1 Nb6 for positron emission tomography imaging in lung cancer tumor mice model. Bioorganic & Medicinal Chemistry Letters 30, 126915 (2020).
13 Li, D. et al. Immuno-PET imaging of 89Zr labeled anti-PD-L1 domain antibody. Molecular pharmaceutics 15, 1674-1681 (2018).
14 Xing, Y. et al. Early Phase I study of a 99mTc-labeled anti–programmed death ligand-1 (PD-L1) single-domain antibody in SPECT/CT assessment of PD-L1 expression in non–small cell lung cancer. Journal of Nuclear Medicine 60, 1213-1220 (2019).
15 Ries, J., Kaplan, C., Platonova, E., Eghlidi, H. & Ewers, H. A simple, versatile method for GFP-based super-resolution microscopy via nanobodies. Nature methods 9, 582-584 (2012).