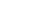原核表达包涵体复性实例
前言
包涵体在原核表达中非常常见,但是没有一个通用的复性解决方案,常用的复性手段有稀释复性、透析复性、分子筛及离子柱层析等,复性遵循原则:低温、低浓度、小梯度,下面我们分享三个蛋白复性的实例。
先复性后纯化
细菌破碎后离心收集沉淀,trisbuffer洗涤包涵体3-5次,跑胶检测包涵体纯度
用5-10ml 6M盐酸胍(ph1.5)溶解包涵体,室温搅拌30min-1h,离心去除不溶物;
将溶解后包涵体蛋白快速滴定到4℃预冷pbs中,缓慢搅拌,过夜复性,离心去除沉淀;
缓慢加(40%)硫酸铵,3h后离心去沉淀(未完全复性的蛋白);加终浓度70%硫酸铵,4℃过夜孵育,离心取沉淀,溶解到5-10ml pbs中即为目的蛋白。
复性结果如下图所示

图1.包涵体检测
泳道1:盐酸胍溶解包涵体 泳道2:包涵体洗涤后

图2.蛋白复性后检测
1.破胞后洗涤沉淀,沉淀用变性剂buffer(8M脲)室温溶解3h后高速离心去除沉淀,上清中加入Ni填料,4℃混匀孵育2h;
2.孵育结束后转移beads至层析柱,依次用不同浓度咪唑Wash buffer冲洗柱子;
3.Elute buffer洗脱蛋白后跑胶检测纯度;
4.包涵体复性:变性蛋白测浓度后滴定入复性buffer( 100 mM Tris–HCl, 0.5M 甘氨酸, 1 mM氧化型谷胱甘肽,10 mM 还原型谷胱甘肽, pH8.0) ,使蛋白终浓度为0.1mg/ml, 缓慢搅拌,4℃复性反应过夜,离心去除沉淀,上清转移到透析袋,pbs透析4h,换液至少2次,浓缩后过分子筛。
复性结果如下图所示
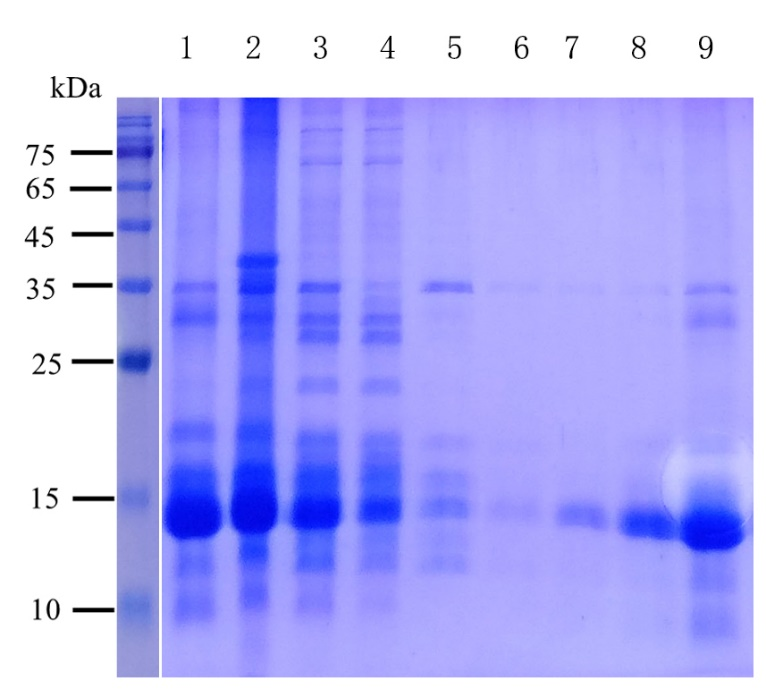
图3.包涵体纯化结果
泳道1为包涵体溶解后上清,泳道2为包涵体溶解后沉淀,泳道3为20mM洗杂,泳道4为40mM洗杂,
泳道5为60mM洗杂,泳道6为100mM洗杂,泳道7为300mM洗脱,泳道8、9为500mM洗脱
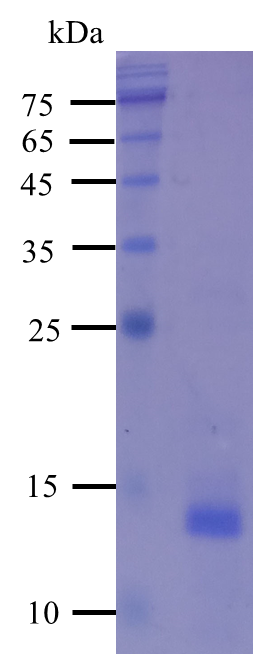
图4.复性后检测结果
柱上复性
层析柱上复性与普通亲和层析操作类似,只是在细胞破碎时候用变性buffer(如8M脲),离心后上清蛋白溶液正常上层析柱,洗杂过程中依次降低变性剂含量,如8M-6M-4M-2M-1M-0.5M-0,使蛋白在层析柱上复性,最后用不含变性剂的咪唑buffer洗脱,即可得到复性后蛋白,实例图如下:
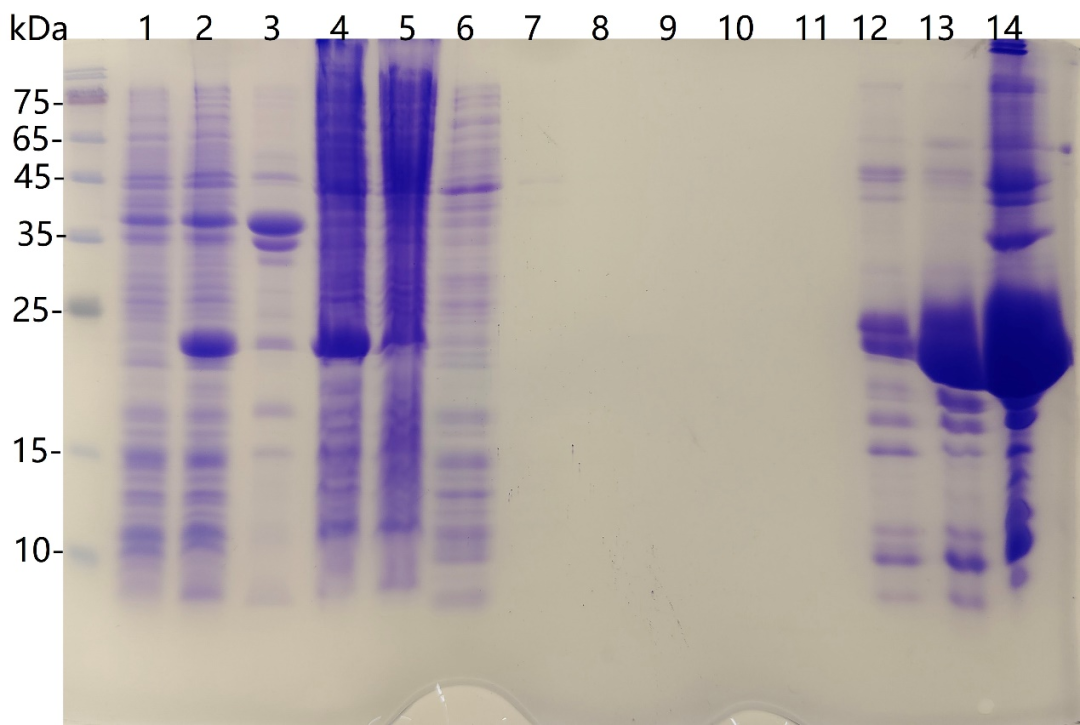
图5.亲和层析结果
泳道1为诱导前,泳道2为诱导后,泳道3为破碎后沉淀(变性剂破碎),泳道4为破碎后上清(变性剂破碎),
泳道5为,泳道6为6M尿素洗杂,泳道7为4M尿素洗杂,泳道8为2M尿素洗杂,泳道9为1 M尿素洗杂,
泳道10为0.5M尿素洗杂,泳道11为0M尿素复性洗杂,泳道12为300mM咪唑洗脱,泳道13、14为500mM咪唑洗脱。
复性洗脱后根据实验需求再进一步纯化即可。
小结
包涵体形成原因较多,方法也就不一而论,需要各种尝试才能找到一个合适的方法,需要一点运气,更需要的是对科研的探索精神。