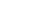酵母展示——筛选高亲和力靶向膜蛋白抗体

膜蛋白,如离子通道和G蛋白偶联受体(GPCRs),是药物发现的重要靶点,但针对这类靶点的特异性抗体和多肽的开发和优化常常面临挑战。传统的筛选方法受限于抗原的呈现方式和筛选效率。论文“A cell–cell interaction format for selection of high affinity antibodies to membrane proteins”中,研究者结合了酵母展示技术和FACS(fluorescence-activated cell sorting)筛选技术,阐述了基于细胞间相互作用捕获膜蛋白特异性抗体的方法。该方法的主要优点在于:1.省去了复杂且繁琐的膜蛋白纯化步骤;2.更好的保持了膜蛋白的生理构象;3.能够选择性的筛选出结合胞外段的抗体。
实验方法:
如图1所示,首先,研究者构建了表达EGFP的酵母展示库,以及表达目的膜蛋白和mCherry的哺乳动物细胞;第二步,将酵母细胞与哺乳动物细胞共培养;第三步,利用流式细胞分选仪分选出具有EGFP和mCherry双荧光信号的酵母-哺乳动物细胞复合物;第四步,扩增培养第三步获得的酵母细胞。将以上四步循环进行3到5轮,富集得到能够与表达在细胞膜表面的膜蛋白特异结合的酵母株。
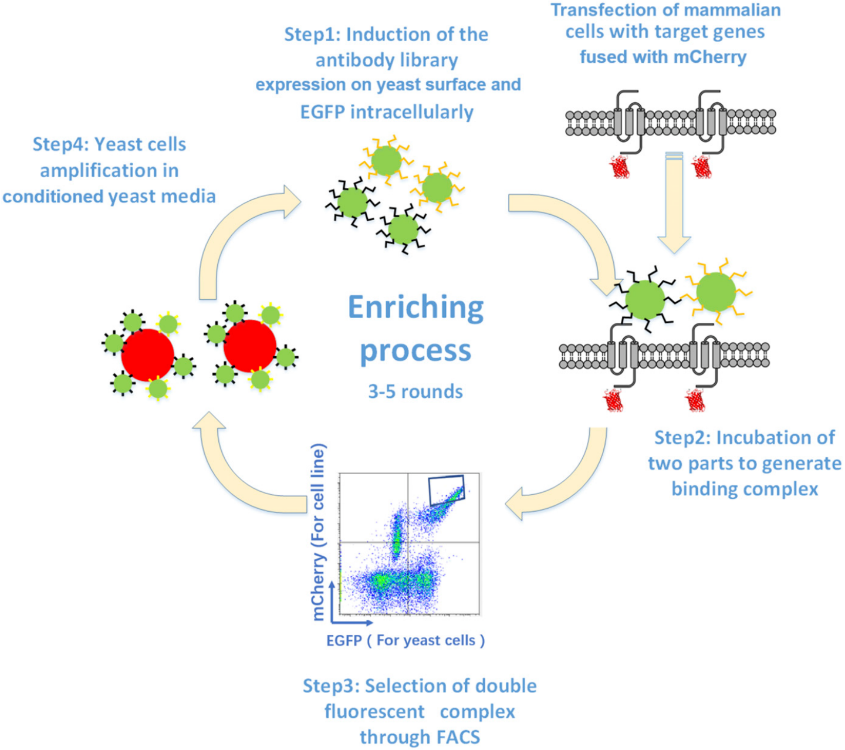
图1. 利用酵母和哺乳动物细胞之间的细胞间相互作用进行抗体等的筛选示意图
应用实例1——膜蛋白抗体的亲和力成熟
ASC06是human acid-sensing ion channel 1a (hASIC1a)的抑制型抗体,研究者构建了ACS06的CDR3区的突变文库,并制备了酵母展示库,按照图1所示流程进行了5轮筛选,在第4轮筛选后,阳性双荧光信号从初始文库的 0.075% 增加到 3.16%,表明高亲和力抗体得到了富集(图 2A)。在五轮选择之后,分离并测序了 100
个克隆,发现了两种主要的突变类型:YF取代原始DSFYGYSKGD序列中的FY(41个克隆)和RA取代YS(19个克隆)。通过表面等离子体共振 (SPR) 测量这些抗体与hASIC1a的亲和力(图 2C)。结果显示,与野生型相比,两种突变体的亲和力增加了两到三倍(从0.28 nM野生型到0.10 nM ASC03 和0.12 nM ASC28)。研究者还通过在不同浓度抗体存在下使用电压敏感染料通过荧光成像板读数器 (FLIPR) 测量膜电位来确定抗体的IC50。与野生型抗体相比,两种突变抗体表现出更好的IC50,表明它们在抑制酸诱导的hASIC1a电流方面具有提高的效力(图 2D)。
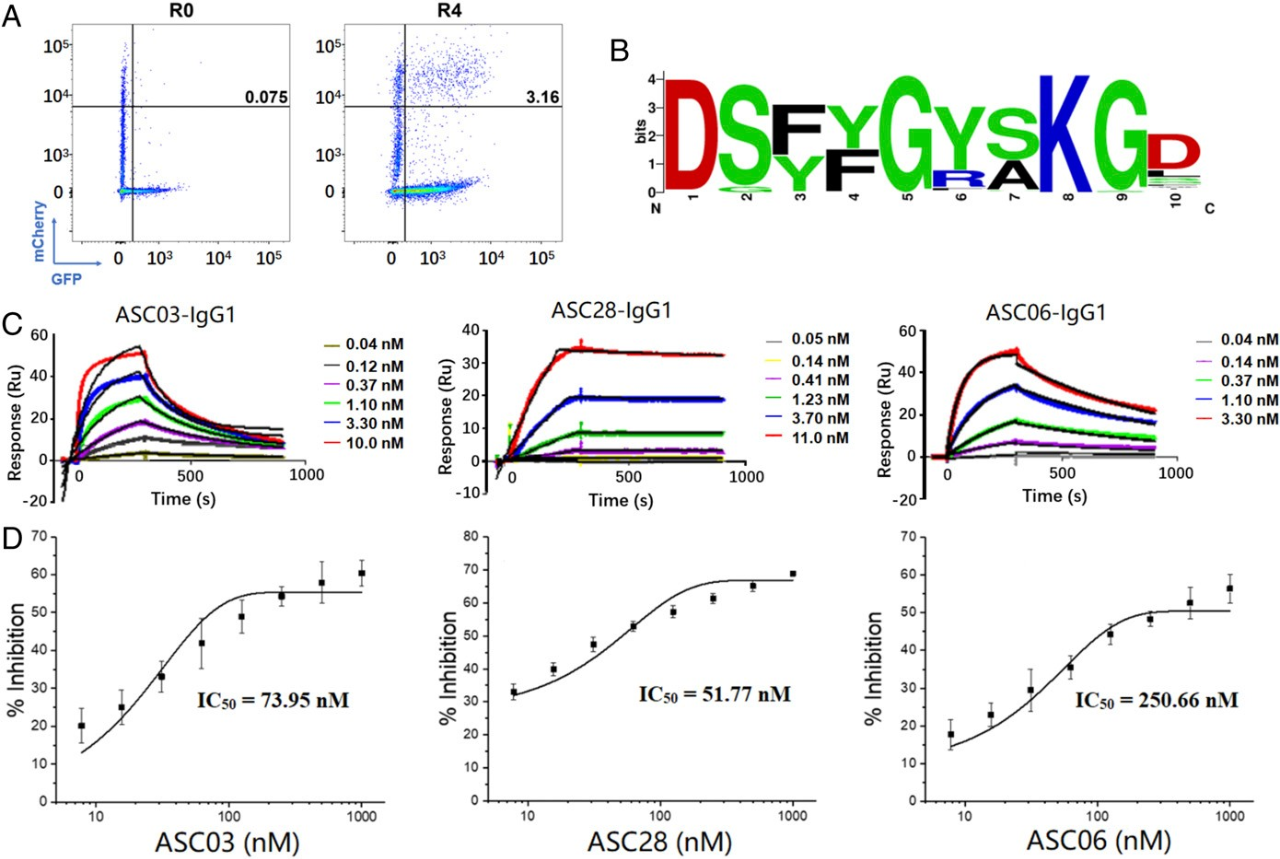
图2. 靶向hASIC1a抗体ASC06的亲和力成熟和富集克隆的表征。(A) CHO/hASIC1a-mCherry细胞混合物与初始酵母文库(R0)或第4轮富集后的酵母文库(R4)的FACS分析结果;(B) 经过五轮筛选后测序的100个克隆的H-CDR3的WebLogo图,以显示H-CDR3内每个位置的氨基酸分布;(C) SPR测量抗体ASC03、ASC06和ASC28的亲和力谱图,原始数据用彩色线表示,黑线是拟合曲线;(D) 抗体ASC03-IgG1、ASC06-IgG1和ASC28-IgG1抑制酸诱导hASIC1a电流的IC50。
应用实例2——靶向人μ-opioid receptor (hMOR)抗体的发现
GPCR是重要的药物靶标,但使用既定方法制备针对这些跨膜蛋白的特异性抗体一直颇具挑战性,这主要是因为难以以正确的构象呈递抗原。研究者将人源scFv天然酵母库与过表达人类 GPCR μ-opioid receptor (hMOR)的哺乳动物细胞孵育。进行了四轮筛选以富集靶向hMOR-mCherry过度表达细胞的抗体,并对30个克隆进行了测序以分析富集情况(图 3A)。挑选了三个富集度最高的序列进行进一步表征,其中两个克隆表现出特异性结合(图 3B)。免疫荧光染色实验显示,Ab3和Ab17的亲和力分别为76 nM和280 nM(图 3C)。
图 3. 靶向hMOR-mCherry过表达细胞的抗体筛选及阳性抗体的表征。(A)对与hMOR-mCherry过表达CHO细胞孵育的初始文库(R0)和经过三轮筛选(R3)后的文库进行FACS分析;(B)FACS分析Ab3和Ab17与野生型CHO细胞和hMOR过表达CHO细胞的结合情况;(C)利用免疫荧光鉴定Ab3和Ab17的亲和力。
小 结
靶向膜蛋白(例如离子通道蛋白和GPCR)的抗体具有重大应用价值的同时也伴随着较高的开发难度。酵母与哺乳动物细胞互作的筛选方法绕过了膜蛋白纯化步骤,能够直接富集靶向天然状态下的“难以纯化的膜蛋白”的抗体,也可以应用于抗体的亲和力成熟改造中。
本期参考文献:
Yang, Zhuo, et al. "A cell–cell interaction format for selection of high-affinity antibodies to membrane proteins." Proceedings of the National Academy of Sciences 116.30 (2019): 14971-14978.
原文下载链接: