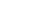GPCR蛋白概述
G 蛋白偶联受体 (GPCR),也称为七次跨膜结构域受体、7TM 受体,是一大类细胞表面受体蛋白。它们能够被细胞外的分子并激活并引起细胞反应。在结构上,它们七次穿过细胞膜,并在细胞内与G蛋白偶联 [1]。 配体可以结合到细胞外 N 末端和环(例如谷氨酸受体)或跨膜螺旋(类视紫红质家族)内的结合位点,从而激活或抑制受体。当配体与 GPCR 结合时,它会导致 GPCR 发生构象变化,从而使其充当鸟嘌呤核苷酸交换因子 (GEF)。 然后 GPCR 可以激活相关的 G 蛋白,使与 G 蛋白结合的 GDP 交换为 GTP 。 然后,G 蛋白的 α 亚基与结合的 GTP 一起从 β 和 γ 亚基上解离,进一步影响细胞内信号蛋白或直接根据 α 亚基类型 (Gαs, Gαi/o, Gαq/11, Gα12/13)靶向功能蛋白 [2]。
图一. 七次跨膜受体蛋白GPCR结构与活性示意图 [3]。
生理
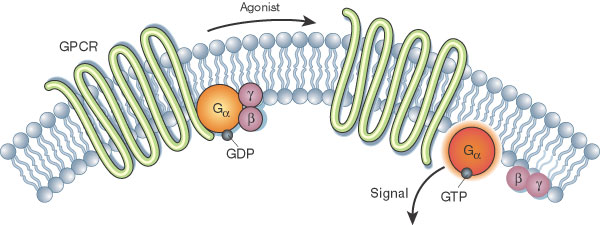
G 蛋白偶联受体仅存在于真核生物中。能够结合并激活这些受体的配体包括光敏化合物、气味、信息素、激素和神经递质,其大小从小分子到肽再到大蛋白质不等。GPCR参与多种生理过程,因而与许多疾病有关。它们参与的生理过程包括:
视觉:视蛋白使用光异构化反应将电磁辐射转化为细胞信号。
味觉:味觉细胞中的GPCR介导味导素的释放以响应苦味、鲜味和甜味物质。
嗅觉:嗅觉上皮细胞的受体结合气味物质和信息素。
行为和情绪调节:哺乳动物大脑中的受体结合多种不同的神经递质,包括血清素、多巴胺、组胺、GABA和谷氨酸。
免疫系统活动和炎症的调节:趋化因子受体结合介导免疫系统细胞间通讯的配体,如组胺受体结合炎症介质并使靶细胞类型参与炎症反应。 GPCR 还参与免疫调节,例如,调节白介素诱导或抑制 TLR 诱导的 T 细胞免疫反应 [4]。
自主神经系统传输:交感神经系统和副交感神经系统均受 GPCR 通路调节,负责控制身体的许多自动功能,如血压、心率和消化过程。
细胞密度传感。
稳态调节(例如水平衡)[5]。
参与某些类型肿瘤的生长和转移 [6]。
图二. GPCR在人体参与的主要生理活动 [7]
由于GPCR参与了与许多疾病相关的信号通路,即精神、代谢包括内分泌失调、免疫包括病毒感染、心血管、炎症、感觉障碍和癌症,GPCR是一个重要的药物靶标。在所有FDA批准的药物中,大约34%的药物靶向该家族的 108 个成员。 截至2018年,这些药物的全球销售额估计为1800亿美元。 据估计,GPCR是目前市场上约 50% 药物的靶标 [8]。
分类
GPCR蛋白质超家族的确切大小还未知,但根据基因组序列分析预测,人类基因组至少有 831个不同基因对其进行编码,约为整个蛋白质编码基因组的4%。 针对这个蛋白质家族已经提出了许多分类方案 [9]。
A-F 分类法根据序列同源性和功能相似性将GPCR分为 6 类:
A类 (Rhodopsin-like)
B类 (Secretin receptor family)
C类 (Metabotropic glutamate/pheromone)
D类 (Fungal mating pheromone receptors)
E类 (Cyclic AMP receptors)
F类 (Frizzled/Smoothened)
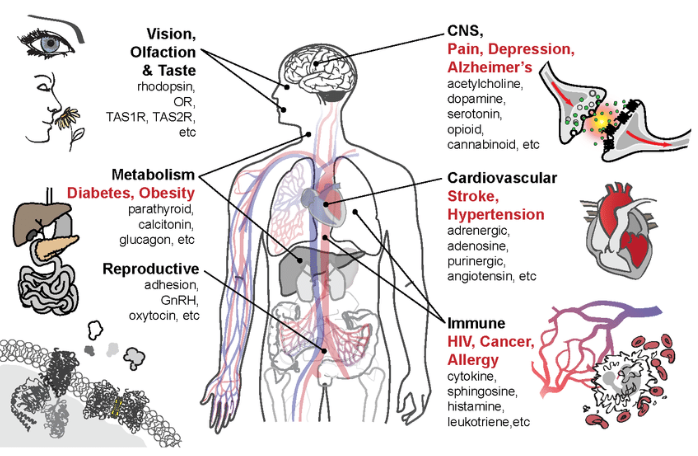
最近,一种称为 GRAFS(Glutamate, Rhodopsin, Adhesion, Frizzled/Taste2, Secretin)的替代分类系统已被提议用于脊椎动物 GPCR,它们分别对应于经典A-F 分类中的C类、A类、B2类、F类 和 B类 [10]。
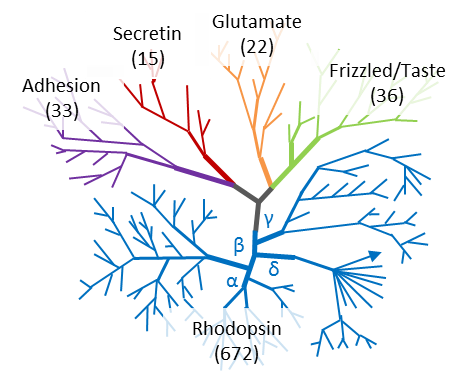
图三. GPCR家族的GRAFS分类法 [11]
尽管类别之间缺乏序列同源性,但所有GPCR都具有共同的结构和信号转导机制。迄今为止最大的一类是A类,占GPCR基因的近85%。 A类GPCR进一步细分为19个亚组(A1-A19) [12]。在 A 类GPCR中,预计其中一半以上成员编码嗅觉受体。
功能机制
简单来说,GPCR被配体或其他形式的外部信号激活,从而使受体产生构象变化,导致G 蛋白激活。 G蛋白激活在细胞内产生的影响取决于G蛋白的类型,G蛋白随后被称为RGS(Regulators of G-protein Signaling)的蛋白灭活。
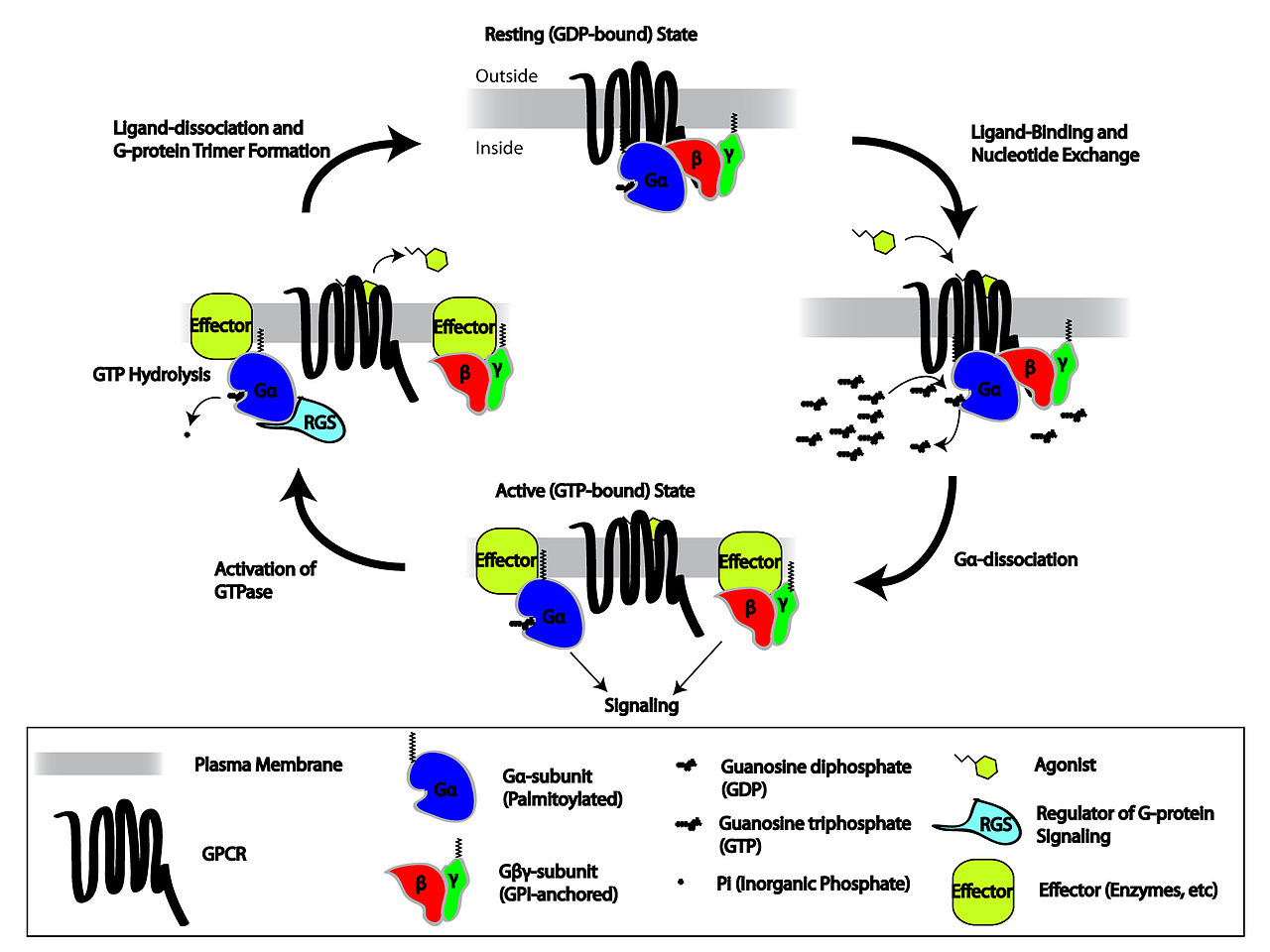
图四. GPCR-G蛋白激活过程示意图[13]
配体结合
人体内受体为GPCR的配体为:感觉信号介质(例如光和嗅觉刺激分子)、 腺苷、铃蟾肽、缓激肽、内皮素、γ-氨基丁酸 (GABA)、肝细胞生长因子 (HGF)、黑皮质素、神经肽 Y、阿片肽、视蛋白、生长抑素、GH、速激肽、血管活性肠肽家族成员、加压素、生物胺(如多巴胺、肾上腺素、去甲肾上腺素、组胺、血清素和褪黑激素)、谷氨酸(代谢型)、 胰高血糖素; 乙酰胆碱(毒蕈碱作用)、趋化因子、炎症的脂质介质(例如前列腺素、血小板活化因子和白三烯)、肽激素(例如降钙素、C5a 过敏毒素、促卵泡激素 [FSH]、促性腺激素释放激素 [GnRH]、神经激肽、促甲状腺激素释放激素[TRH]和催产素)、内源性大麻素等等。
受体构象变化
在非活性状态下,GPCR 与异源三聚体 G 蛋白复合物结合。 激动剂与 GPCR 的结合导致受体的构象变化,这种变化通过蛋白质结构域动力学传递给异源三聚体 G 蛋白中的 Gα 亚基。 激活的 Gα 亚基结合 GTP 代替 GDP,进一步触发 Gα 亚基从 Gβγ 二聚体和受体解离。 解离的 Gα 和 Gβγ 亚基与其他细胞内蛋白相互作用,继续信号级联转导,而释放的 GPCR 能够重新结合到另一个异源三聚体 G 蛋白,形成一个新的复合物,准备启动另一轮信号转导 [14]。
受体分子存在于活性和非活性生物物理状态之间的构象平衡中[15]。配体与受体的结合可能会使平衡向活性状态移动。GPCR的配体存在三种类型:激动剂是使平衡向有利于活性状态的方向移动的配体; 反向激动剂是使平衡向非活性状态倾斜的配体; 中性拮抗剂是不影响平衡的配体。
G蛋白激活/灭活
G 蛋白是由 α、β 和 γ 亚基(分别称为 Gα、Gβ 和 Gγ)构成的异源三聚体,可以结合鸟苷二磷酸 (GDP)或者在活性状态下结合三磷酸鸟苷 (GTP)。当GPCR受体处于非活性状态时,其GEF 结构域可能会与G 蛋白中同样处于非活性状态的 α-亚基结合。在受体被激活后,GEF 结构域反过来通过促进 G 蛋白 α 亚基中的 GDP 分子与 GTP 的交换来变构激活 G 蛋白。 细胞质中GTP与GDP的比例维持在10:1,因此可以实现 GDP/GTP 的交换。 GDP/GDP交换的同时,G 蛋白的与受体以及G 蛋白的亚基彼此解离,产生 Gα-GTP 单体和Gβγ 二聚体,自由调节其他细胞内蛋白的活性。
由于Gα 还具有GTP→GDP 水解能力,α-亚基 (Gα-GDP) 的非活性形式会再生,从而允许与 Gβγ 二聚体重新结合形成非活性状态G 蛋白,并再次与GPCR结合等待激活。 由于另一个变构调节蛋白家族-RGS(Regulators of G-protein Signaling)蛋白的作用,GTP 水解速率通常会加快。RGS是 GTP 酶激活蛋白(GTPase-Activating Protein, GAP)的一种。 事实上,许多在与 Gα-GTP 相互作用后被激活/失活的主要效应蛋白(例如,腺苷酸环化酶)也具有 GAP 活性。 因此,即使在这个过程的早期阶段,GPCR 发起的信号也具有自我终止的能力。
参考文献
1. Trzaskowski B, Latek D, Yuan S, Ghoshdastider U, Debinski A, Filipek S (2012). "Action of molecular switches in GPCRs--theoretical and experimental studies". Current Medicinal Chemistry. 19 (8): 1090–109.
2. Wettschureck N, Offermanns S (October 2005). "Mammalian G proteins and their cell type specific functions". Physiological Reviews. 85 (4): 1159–204.
3. Joshua Li, Yuhong Ning, Warren Hedley, Brian Saunders, Yongsheng Chen, Nicole Tindill, Timo Hannay, Shankar Subramaniam (2002). The Molecule Pages database. Nature 420, 716-717.
4. Saroz Y, Kho DT, Glass M, Graham ES, Grimsey NL (December 2019). "Cannabinoid Receptor 2 (CB2) Signals via G-alpha-s and Induces IL-6 and IL-10 Cytokine Secretion in Human Primary Leukocytes". ACS Pharmacology & Translational Science. 2 (6): 414–428.
5. Hazell GG, Hindmarch CC, Pope GR, Roper JA, Lightman SL, Murphy D, et al. (January 2012). "G protein-coupled receptors in the hypothalamic paraventricular and supraoptic nuclei--serpentine gateways to neuroendocrine homeostasis". Frontiers in Neuroendocrinology. 33 (1): 45–66.
6. Dorsam RT, Gutkind JS (February 2007). "G-protein-coupled receptors and cancer". Nature Reviews. Cancer. 7 (2): 79–94.
7. Liu W, Wacker D, Gati C, Han GW, James D, Wang D, Nelson G, Weierstall U, Katritch V, Barty A, Zatsepin NA, Li D, Messerschmidt M, Boutet S, Williams GJ, Koglin JE, Seibert MM, Wang C, Shah ST, Basu S, Fromme R, Kupitz C, Rendek KN, Grotjohann I, Fromme P, Kirian RA, Beyerlein KR, White TA, Chapman HN, Caffrey M, Spence JC, Stevens RC, Cherezov V (2013). Serial femtosecond crystallography of G protein-coupled receptors. Science.Dec 20;342(6165):1521-4.
8. Hauser AS, Chavali S, Masuho I, Jahn LJ, Martemyanov KA, Gloriam DE, Babu MM (January 2018). "Pharmacogenomics of GPCR Drug Targets". Cell. 172 (1–2): 41–54.e19.
9. Bjarnadóttir TK, Gloriam DE, Hellstrand SH, Kristiansson H, Fredriksson R, Schiöth HB (September 2006). "Comprehensive repertoire and phylogenetic analysis of the G protein-coupled receptors in human and mouse". Genomics. 88 (3): 263–73.
10. Krishnan A, Almén MS, Fredriksson R, Schiöth HB (2012). Xue C (ed.). "The origin of GPCRs: identification of mammalian like Rhodopsin, Adhesion, Glutamate and Frizzled GPCRs in fungi". PLOS ONE. 7 (1): e29817.
11. https://www.adhesiongpcr.org/adhesion-gpcrs/
12. Joost P, Methner A (October 2002). "Phylogenetic analysis of 277 human G-protein-coupled receptors as a tool for the prediction of orphan receptor ligands". Genome Biology. 3 (11).
13. https://en.wikipedia.org/wiki/G_protein-coupled_receptor#cite_note-pmid17095603-45
14. Digby GJ, Lober RM, Sethi PR, Lambert NA (November 2006). "Some G protein heterotrimers physically dissociate in living cells". Proceedings of the National Academy of Sciences of the United States of America. 103 (47): 17789–94.
15. Rubenstein LA, Lanzara RG (1998). "Activation of G protein-coupled receptors entails cysteine modulation of agonist binding". Journal of Molecular Structure: Theochem. 430: 57–71.