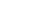视紫红质与视觉
人的眼可分为折光系统(角膜,房水,晶状体和玻璃体)和含感光细胞(视杆细胞和视锥细胞)的视网膜两部分。人眼能看清物体是由于物体所发出的光线经过眼内折光系统发生折射,成像于视网膜上,视网膜上的感光细胞——视锥细胞和视杆细胞能将光刺激所包含的视觉信息转变成神经信息,经视神经传入至大脑视觉中枢而产生视觉。其适宜刺激是频率为300~750太赫兹的电磁波,即可见光部分(1)。
视网膜的结构(2)
视紫红质(rhodopsin)是一种在视杆细胞中发现的蛋白质,每个视杆细胞外段包含109个视紫红质分子。它在光照射下发生的一系列光化学变化是整个视觉过程的起始点。
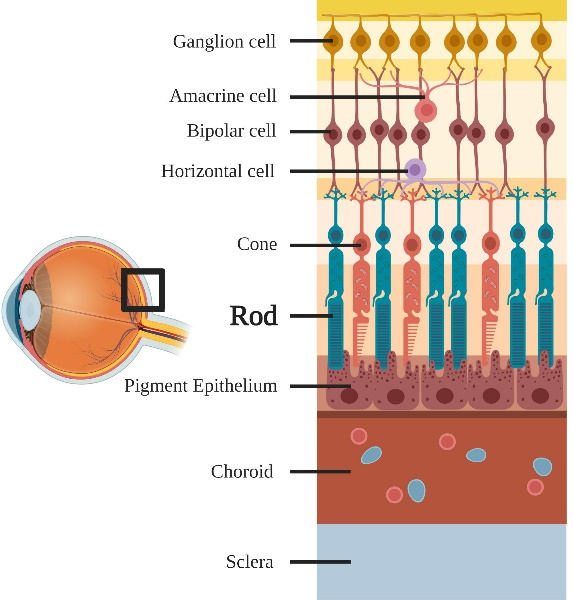
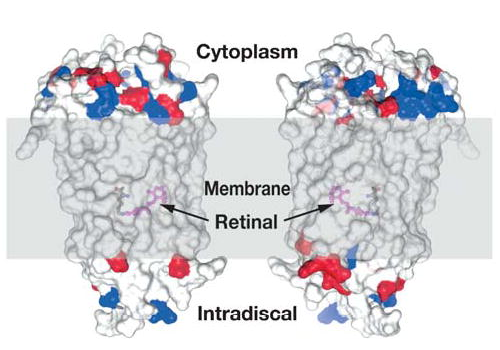
视紫红质是一种由RHO基因编码的G蛋白偶联受体(GPCR)蛋白质,可触发视杆细胞中的视觉光转导。之所以被称为视紫红质是由于它是一种色素蛋白,具有一定的光谱吸收特性,在暗中呈粉红色(3)。在结构上,它由视蛋白(一种无色蛋白质)和 11-顺式视黄醛组成,这是一种从维生素 A 中提取的色素分子。当眼睛暴露在光线下时,视紫红质中呈扭曲形的 11-顺式视黄醛成分转化为直线形的全反式视黄醛,后者不再能和视蛋白相结合,经过一系列不稳定的中间产物后,视黄醛与视蛋白相分离。 在这一过程中,视紫红质失去其颜色,称为漂白。视紫红质蛋白质构象的变化在视杆内启动光转导级联,从而将光转换为电信号,然后沿着视神经传输到大脑中的视觉皮层。漂白限制了视杆细胞受到刺激的程度,降低了它们对强光的敏感性,并允许视锥细胞(视网膜中的另一种光感受器)在明亮的环境中调节视觉(4)。
细胞膜(灰色)上视紫红质和其中11-顺式视黄醛的示意图
暗处在酶的作用下,视黄醛又变为11-顺式,并重新与视蛋白相结合,使视紫红质再生(复生),完成视觉循环。在强光照射后,视紫红质大部分被漂白,其重新合成需要约1小时。随着视紫红质的复生,视网膜的对光敏感度逐渐恢复,这是暗适应的光化学基础。视紫红质在亮处分解,在暗处又可重新合成。人在暗处视物时,实际上既有视紫红质的分解,又有它的合成。光线愈暗,合成过程愈超过分解过程,这是人在暗处能不断看到物质的基础。相反在强光作用下,视紫红质分解增强,合成减少,视网膜中视紫红质大为减少,因而对弱光的敏感度降低。故视杆细胞对弱光敏感,与黄昏暗视觉有关。视紫红质在分解和再合成过程中,有一部分视黄醛将被消耗,主要靠血液中的维生素A补充。如维生素A缺乏,则将影响人在暗处的视力称为夜盲症(5)。
在光照下视紫红质中的视黄醛变化(6)
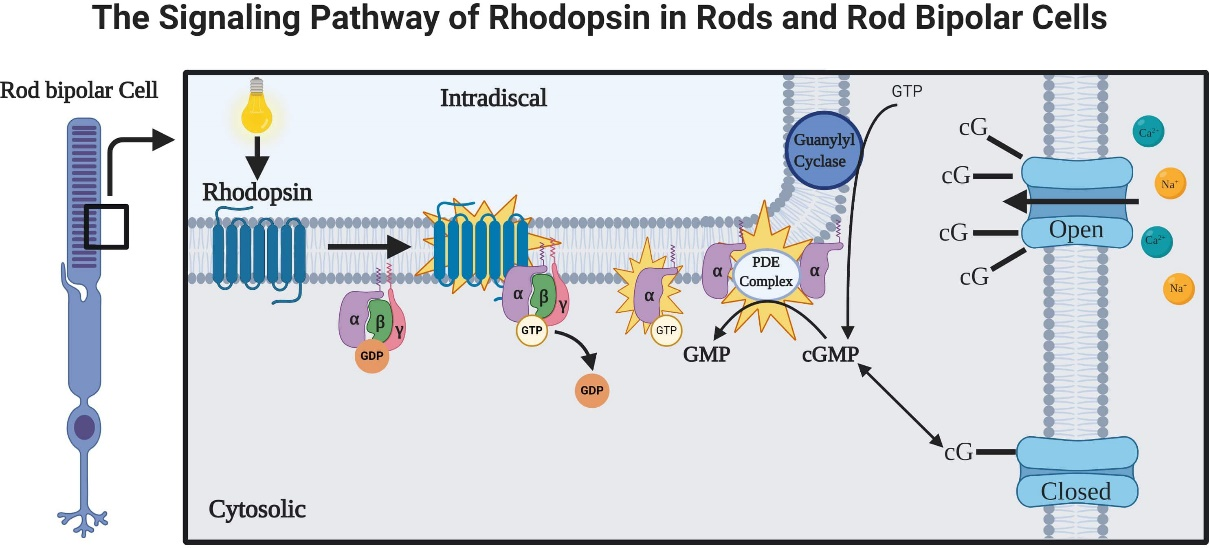
视紫红质介导的信号转导级联(7)
当视紫红质被光照射时,视黄醛从顺式到反式的变化引起视紫红质蛋白构象的变化,从而激活下游感受器G蛋白。G蛋白的激活会启动 GTP 和 GDP 的交换,并释放其 α 亚基。 与 GTP 结合的α亚基反过来激活 cGMP 磷酸二酯酶(PDE complex)。 cGMP 磷酸二酯酶水解(分解)cGMP,降低其局部浓度。 cGMP 浓度的降低将关闭 cGMP 门控通道。由于该通道通过 Na+ 和 Ca2+ 的流入使杆状双极细胞的膜电位去极化,cGMP 浓度降低引起的通道关闭导致杆状细胞超极化,从而改变它们释放递质的速率(8)。
视紫红质具有G蛋白偶联受体的经典7次跨膜螺旋结构,形成3个胞外环和3个胞内环。与视紫红质具有相似结构的GPCR被称为类视紫红质 GPCR。类视紫红质 GPCR 代表了一个分布广泛的蛋白质家族,也是成员最多的GPCR家族,包括激素、神经肽、神经递质和光受体,所有这些受体都通过与G蛋白相互作用来转导细胞外信号。 尽管它们的激活配体在结构和特征上差异很大,但受体的氨基酸序列非常相似,并且被认为具有 7 次跨膜螺旋的共同结构框架(9)。
参考文献
1. Michael F. Land, The Human Eye: Structure and Function, Nature Medicine, 1999
2. Cameron Lenahan, Rajvee Sanghavi, Lei Huang, and John H. Zhang, Rhodopsin: A Potential Biomarker for Neurodegenerative Diseases, Front Neurosci. 2020
3. K Palczewski, G protein–coupled receptor rhodopsin, Annu. Rev. Biochem., 2006
4. Wald G, Carotenoids and the Vitamin A Cycle in Vision, Nature. 1934
5. Deepshe Dewett, Khanh Lam-Kamath, Clara Poupault, Heena Khurana, Jens Rister, Mechanisms of vitamin A metabolism and deficiency in the mammalian and fly visual system, Developmental Biology, 2021
6. Lehninger Principles of Biochemistry, Fifth Edition
7. Lenahan C, Sanghavi R, Huang L, Zhang JH, Rhodopsin: A Potential Biomarker for Neurodegenerative Diseases, Front Neurosci. 2020
8. Kong Y, Karplus M., The signaling pathway of rhodopsin, Structure. 2007
9. Dixon RA, Sigal IS, Rands E, Register RB, Candelore MR, Blake AD, Strader CD, Ligand binding to the beta-adrenergic receptor involves its rhodopsin-like cor. Nature. March 1987