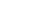羊驼免疫产生高水平的纳米抗体——动物免疫
动物产生抗体的机理:抗原免疫动物→激活B细胞→转化成浆细胞→分泌针对抗原的特异性的抗体。抗体产生是从抗原刺激免疫动物产生强烈免疫应答开始的,离不开高效的动物免疫,实际操作中以检测血清中抗体效价来衡量实际免疫效果[1]。
动物免疫中的抗原
为了制备特异性强,效价高,亲和力好的优质免疫抗体,首选必须要有合适的抗原。抗原的基本特性包括免疫原性和反应原性。免疫原性是指某抗原能作用于T细胞、B细胞的抗原识别受体,进而诱导机体产生免疫应答的特性。反应原性是指抗原与相应的抗体发生特异性结合的特性, 此特性又称为免疫反应性。抗原的反应性取决于抗原决定簇,或称为表位,是抗原与抗体分子特异结合的区域,一个抗原分子可带有不同的决定簇[2]。反应原性与抗原决定簇的性质、空间、位置、立体构象以及种属差异等密切相关。而免疫源性与抗原本身的多种因素相关[3-6],包括:
异源性:自体或自身抗原通常免疫原性较差,抗原与宿主生物之间的异源性越大,免疫反应越强。
分子大小:抗原分子量越低 ,其免疫原性相对偏弱。例如,分子质量大于100,000 Da的分子通常是活跃的免疫原,而小于5,000-10,000 Da的分子则免疫原性较差。
化学性质和组成:抗原主要是由蛋白质、多糖、脂质或核酸组成的。蛋白质具有最强的免疫原性,其次是多糖;而脂质与核酸一般并不能成为免疫原,常常要借由与蛋白质结合才能激活免疫应答反应。一般来说,物质的化学成分越复杂,其免疫原性就越强。
降解性:易被吞噬的抗原通常更具免疫原性,这是因为对于大多数抗原(T依赖性抗原),免疫反应的发展要求抗原被APC吞噬、处理并呈递给辅助性T细胞。
根据抗原的免疫原性与反应原性,抗原可分类为完全抗原与不完全抗原。完全抗原既具有免疫原性又有反应原性[7]。不完全抗原只具有反应原性而缺乏免疫原性, 亦称为半抗原[8]。半抗原单独作用于机体的免疫系统时无免疫原性,当与蛋白载体结合形成半抗原-载体偶联物时,即可获得免疫原性。例如,合成肽抗原通常太小而不能刺激宿主免疫系统产生显着的免疫应答,需与KLH、BSA、OVA等载体蛋白交联后成为完全抗原才能刺激宿主产生相应的抗体。需要注意的是,这种偶联物不但可刺激机体的免疫系统产生针对半抗原的抗体,也可以刺激机体产生针对蛋白质载体的抗体,因此在抗体筛选时需再偶联另一种不同的载体蛋白进行筛选。
为了达到更好的免疫效果以获得高质量的抗原特异性抗体,除了抗原本身的性质,免疫过程中的操作和免疫动物的选择等因素也至关重要。
抗原制备和乳化
免疫用的抗原一般为溶液和冻干粉两种形式。冻干粉加生理盐水或PBS后放室温30 min充分溶解,在溶液中的抗原应使用新配制的灭菌生理盐水或PBS稀释。免疫佐剂是指与抗原同时或预先注射到动物体内,可非特异性地增强机体对该抗原的免疫应答的物质 ,又称为非特异性免疫增强剂。可溶性抗原较多采用佐剂免疫法,使抗原与佐剂混合制成稳定乳剂后用于羊驼免疫。颗粒性抗原多采用无佐剂免疫法,将颗粒抗原用PBS或生理盐水制成混悬液(1%)进行免疫。
表一:常见佐剂种类以及其优势和缺点。
常用的抗原乳化方法有乳钵研磨法、注射器推注法,超声乳化法和机械搅拌法等多种[9]。抗原免疫佐剂最常用的是弗氏完全佐剂佐剂和弗氏不完全佐剂,二者的主要差别在于弗氏完全佐剂含有卡介苗,主要成分为矿物油和羊毛脂,它可以增强抗原的免疫原性以及改变机体的免疫反应性,达到增强免疫力或提高抗体产生水平以及使抗原在体内维持时间明显延长等功效。抗原的乳化程度直接影响免疫效果,因此乳化后必须进行质量检查。抗原与弗氏佐剂乳化后性状形成油包水,乳化检查的方法是:将制成的乳剂滴一滴在凉的自来水表面,质量合格的乳剂滴入水面后应保持乳滴珠完整不分散(见图1)。

图1
免疫动物的选择
纳米抗体制备的宿主动物一般选用羊驼[10-12]。动物的遗传因素、营养状况等因素直接影响到动物免疫应答的强弱。有的动物个体甚至有先天免疫缺陷,从而导致免疫失败。动物维生素及氨基酸的缺乏都会使机体的免疫功能下降。环境卫生状况不良,圈舍及周围环境中存在大量病原微生物,在动物免疫期间受到病原的感染,这些都会影响免疫效果。免疫用的羊驼最好选择2-3岁的年青成年动物,免疫系统发育成熟。特别要注意避免使用妊娠期的雌性动物用于制备免疫抗体。
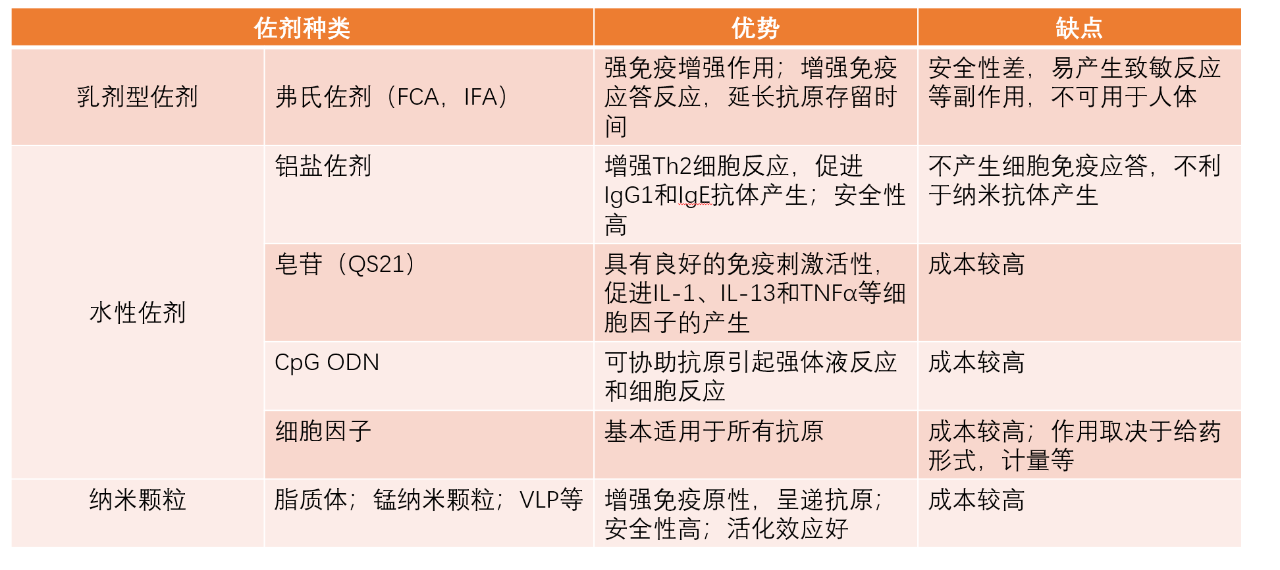
羊驼免疫前的健康状况:体重约50--70 kg,年龄在2-3岁左右;体格发育正常,营养状况及精神状态良好,羊驼背毛光亮;运动及行为无异常,无跛行、不协调等异常的肢势,有警觉性及反应迅速;外部观察无外伤,则可以进行后续的免疫实验(见图2)。免疫前用专用的牌子固定于羊驼的颈部,写明羊驼的牌号,免疫前,还应采血测定动物体内有无滴度交叉反应性天然抗体的存在。为确保动物在整个免疫进程中的健康状态,需要对羊驼来源,饲养环境需进行控制。由于对免疫应答的个别差异,免疫时可选用多只动物进行免疫。

图2
免疫方案
实际操作中,免疫剂量、免疫部位以及免疫间隔时间的组合都会对免疫结果产生较大影响,需对免疫血清抗体效价进行监控,根据实际的免疫效果调整。

图3
免疫途径:不同的免疫途径,包括淋巴结密集区皮下注射,和静脉注射。 一般来说,皮下途径优于静脉途径。因为静脉注射的抗原首先进入脾脏,而皮下注射的抗原首先进入局部淋巴结。羊驼一般选用颈部淋巴节附近左右两侧进行多点注射。
免疫原剂量:免疫原的注射剂量随抗原的性质有较大差异。一般应考虑抗原的免疫原性的强弱、分子量大小、抗原的纯度以及动物个体的状态、免疫途径和免疫时间,佐剂的使用等做相应的调整。剂量过低,不能引起足够强的免疫刺激,免疫剂量过多,有可能引起免疫耐受。在一定的范围内,抗体的效价是随注射剂量的增加而增高。一般而言,抗原量多,时间间隔长,剂量可适当加大。对于纯的可溶性抗原,免疫时一般与等量的弗氏完全佐剂混合进行首次免疫,免疫剂量为500 μg,后续免疫剂量可以与首次剂量相同或为首次剂量的 1/2,颗粒性抗原(细胞)的免疫剂量为5*107-1*108/次。
免疫周期一般随抗原和免疫方法的不同以及是否使用佐剂而变化,间隔时间可从数日到数周。初次免疫与加强免疫的间隔时间多为2周,免疫的总次数多为 4次,半抗原需经长时间的免疫才能达到高效价,可增加1-2次免疫。免疫时间和周期可参考表1羊驼免疫周期表。
测定抗体效价:一般情况下,在加强免疫后7-10天即可采血(见图4),分离血清测定抗体效价。对于免疫性质不确定的小分子和多肽片段等半抗原,一般还应在初免后14天采血测定效价,以确定抗原的免疫原性和动物的反应性。抗体效价的测定方法有很多,常用的方法有ELISA和FACS。
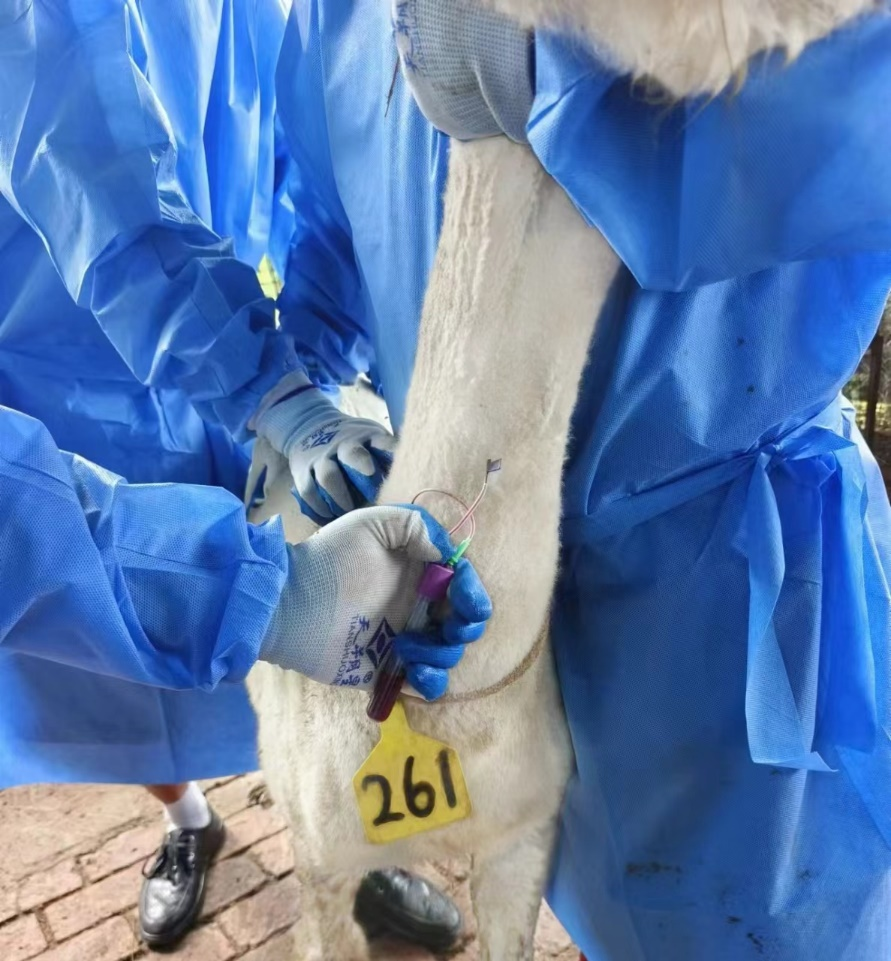
图4
表二:羊驼免疫周期表
图5
本期文章引文
[1] Newmark P. Nobel prize for Japanese immunologist. Nature, 1987, 329(6140): 570.
[2] Greenspan N S. Dimensions of antigen recognition and levels of immunological specificity[J]. 2001, 147-187.
[3] Schmitt M W, Prindle M J, Loeb L A. Implications of genetic heterogeneity in cancer[J]. Annals of the New York Academy of Sciences, 2012, 1267(1): 110-116.
[4] Schellekens H. Factors influencing the immunogenicity of therapeutic proteins[J]. Nephrology Dialysis Transplantation, 2005, 20(suppl_6): vi3-vi9.
[5] Ratanji K D, Derrick J P, Dearman R J, et al. Immunogenicity of therapeutic proteins: influence of aggregation[J]. Journal of immunotoxicology, 2014, 11(2): 99-109.
[6] Kharaziha M, Baidya A, Annabi N. Rational design of immunomodulatory hydrogels for chronic wound healing[J]. Advanced Materials, 2021, 33(39): 2100176.
[7] Murphy, Kenneth. Weaver, Casey. Janeway's immunobiology Ninth edition. New York, NY, USA: Garland Science, Taylor & Francis Group, LLC. 2017. ISBN 978-0-8153-4505-3. OCLC 933586700
[8] Landsteiner, Karl. The Specificity of Serological Reactions, 2nd Edition, revised. Courier Dover Publications. 1990. ISBN 0-486-66203-9.
[9] Lou Y F, Zhang X J, Liu J L, Wang R A, Liu S C, Meng M. Effects of different solvents on the polypeptide antigen’s emulsification[J]. Medical Reserch and Education, 2015, 32(3): 1-5.
[10] Salvador J P, Vilaplana L, Marco M P. Nanobody: outstanding features for diagnostic and therapeutic applications[J]. Analytical and bioanalytical chemistry, 2019, 411: 1703-1713.
[11] Beghein E, Gettemans J. Nanobody technology: a versatile toolkit for microscopic imaging, protein–protein interaction analysis, and protein function exploration[J]. Frontiers in immunology, 2017, 8: 276923.
[12] Bélanger K, Iqbal U, Tanha J, et al. Single-domain antibodies as therapeutic and imaging agents for the treatment of CNS diseases[J]. Antibodies, 2019, 8(2): 27.