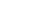免疫荧光染色技术在植物细胞中的应用
一、前言
免疫荧光染色(Immunofluorescence staining)是利用抗原抗体特异性结合原理,并结合荧光标记物对组织、细胞或细胞内蛋白等大分子物质进行定位和定量分析的实验方法。这种技术的特点在于将免疫反应的高特异性和荧光检测技术的高灵敏度相结合,从而实现对目标分子在亚细胞水平上的可视化观察。应用方面,免疫荧光染色技术广泛应用于:基础生物学研究:在细胞生物学中,主要用于研究细胞内蛋白质分布、相互作用、信号转导通路等;
肿瘤标志物检测:免疫荧光技术可用于检测肿瘤细胞中的标志物,从而辅助癌症的诊断和研究;
病原体诊断:免疫荧光技术可以用于检测细菌、病毒等病原体在组织或细胞样本中的存在和分布;
治疗效果评估:近年来,随着新型治疗方法的发展,免疫荧光染色被用来评估这些疗法对特定靶标的影响,例如测定促炎细胞因子的变化情况。
总之,免疫荧光染色技术因其操作相对简便、结果直观且灵敏度高的特点,在科研和临床领域都有着极其广泛的应用。本文介绍一种既简洁又高效的植物细胞免疫荧光染色方法,以供同行专家及学者参考和应用。
实验操作流程见图1(以拟南芥为例,研究叶绿体中蛋白定位)。
图1.流程示意图
二、操作步骤
1、切割叶片
将新鲜采摘的叶片用手术刀片或者锯齿状刀片切成细丝状,然后立马放入固定液中,可收集到1.5ml ep管中避光固定1-2h。可选固定液配方:0.4 M Mannitol, 20 mM KCl, 20 mM MES (pH 5.7), 4% paraformaldehyde,不同物种或组织渗透压可能有差异,注意选择合适的Mannitol浓度。固定后显微镜观察细胞状态,如图2所示,注意组织尽量切得细而碎;
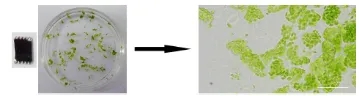
图2.叶片固定效果
2、抗体孵育
将固定后的细胞收集在EP管或小试管中,1 x PBS清洗三次,每次5min。在清洗后的样品中加入适量封闭液室温封闭30min,可选封闭液:含5% BSA和0.15% Triton X-10的 1 x PBS 。加入特定一抗,孵育2h,一抗可直接用封闭液稀释。用含5% BSA的1 x PBS清洗3次,每次5min。加适量带FITC标签二抗避光孵育1h,二抗可用含5% BSA的1 x PBS稀释使用,二抗孵育结束后用1 x PBS清洗3次;
3、样品中加适量0.5M EDTA.Na2 (pH 9.0),55℃水浴1h,结束后去除EDTA,加入封片剂(5 mM 抗坏血酸钠、15 mM Na2HPO4 pH 9.0、50% 甘油),可短时间4℃保存;
4、荧光显微镜观察,观察时可用镊子轻压、敲击盖玻片,使细胞分散均匀,便于观察,结果如图3所示。
可选步骤:细胞壁的存在让抗体进入细胞困难,可在细胞固定后制备原生质体,得到原生质体后再进行后续操作,制备原生质体可参考以下操作;
用含0.5%(W/V)果胶酶和1%(W/V)纤维素酶的1 x TBSTx在37℃酶解1h,倒掉酶解液,用1XTBSTx洗3次,每次10min,注意洗的时候在摇床上慢摇(10xtbst的配置:24.2gTriis,80gNaCL;用HCL调节pH为7.6,定容至1L,加Triton-100使终浓度为1%。)

图3.结果示例
免疫荧光实验是一种常用的生物学研究手段,它利用不同的标记来实现多种研究目的。在实验操作中,需要细心谨慎,同时好的抗体也是实验成功的重要保证。一抗大部分情况下为特别制备抗体,需要在实验中多次摸索稀释比例,二抗一般选择商用FITC二抗,需根据一抗来源选择合适的产品。熟悉原理,操作细心,一定能得到漂亮的免疫荧光染色照片。
参考文献:
Wang, L., et al. (2022). "A Tissue-Chopping Based Immunofluorescence Staining Method for Chloroplast Proteins." Front Plant Sci 13: 910569.